
Сви иЛиве садржаји су медицински прегледани или проверени како би се осигурала што већа тачност.
Имамо стриктне смјернице за набавку и само линкамо на угледне медијске странице, академске истраживачке институције и, кад год је то могуће, медицински прегледане студије. Имајте на уму да су бројеви у заградама ([1], [2], итд.) Везе које се могу кликнути на ове студије.
Ако сматрате да је било који од наших садржаја нетачан, застарио или на неки други начин упитан, одаберите га и притисните Цтрл + Ентер.
Узроци и патогенеза дифтерије
Медицински стручњак за чланак
Последње прегледано: 04.07.2025
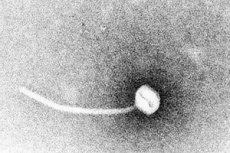
Дифтерија је парадигма токсигених заразних болести. Године 1883, Клебс је показао да је Corynebacterium diphtheriae узрочник дифтерије. Годину дана касније, Лефлер је открио да се организам може култивисати само из назофарингеалне шупљине и предложио да је оштећење унутрашњих органа последица растворљивог токсина. До 1888. године, Ру и Јерсен су показали да животиње којима су убризгани стерилни филтрати C. diphtheriae развијају патологију органа која се не разликује од оне код људске дифтерије; ово је показало да је снажан егзотоксин главни фактор вируленције.
Дифтерија је најчешћа инфекција горњих дисајних путева која изазива грозницу, бол у грлу и малаксалост. Дебела, сивозелена фибринска мембрана, псеудомембрана, често се формира на месту (местима) инфекције као резултат комбинованог дејства раста бактерија, производње токсина, некрозе ткива и имуног одговора домаћина. Схватање да је системско оштећење органа последица дејства дифтеријског токсина довело је до развоја ефикасне терапије засноване на антитоксинима за лечење акутне инфекције и високо ефикасне токсоидне вакцине.
Иако је имунизација токсоидом учинила дифтерију ретком болешћу у подручјима где стандарди јавног здравља захтевају вакцинацију, епидемије дифтерије се и даље јављају код неимунизованих и имунокомпромитованих група. Насупрот томе, широко распрострањене епидемије дифтерије које су достигле епидемијске размере догодиле су се у подручјима где су програми активне имунизације обустављени.
Друге врсте коринебактерија
Поред C. diphtheriae, C. ulcerans и C. pseudotuberculosis, C. pseudodiphtheriticum и C. xerosis могу повремено изазвати назофарингеалне и кожне инфекције. Последња два соја су препознатљива по својој способности да производе пиразинамидазу. У ветеринарској медицини, C. renale и C. kutscheri су важни патогени, који изазивају пијелонефритис код говеда и латентне инфекције код мишева, респективно.
Узроци
Узрочник дифтерије, Corynebacterium diphtheriae, је танак, благо закривљен штапић са палицастим задебљањима на крајевима, непокретан; не формира споре, капсуле или флагеле, и грам-позитиван је.
Поред токсина, дифтеријске коринебактерије током својих животних процеса производе неураминидазу, хијалуронидазу, хемолизин, некротизујуће и дифузне факторе, што може изазвати некрозу и разградњу главне супстанце везивног ткива.
На основу способности да формирају токсине, дифтеријске коринебактерије се деле на токсигене и нетоксигене.
Дифтеријски токсин је снажан бактеријски егзотоксин који одређује и опште и локалне клиничке манифестације болести. Токсигеност је генетски одређена. Нетоксигене коринебактерије дифтерије не изазивају болест.
Према културолошким и морфолошким карактеристикама, све дифтеријске коринебактерије су подељене у 3 варијанте: гравис, митис, интермедијус. Не постоји директна зависност тежине болести од варијанте дифтеријских коринебактерија. Свака варијанта садржи и токсигене и нетоксигене сојеве. Токсигене коринебактерије свих варијанти производе идентичан токсин. [ 1 ]
Структура, класификација и типови антигена
Corynebacterium diphtheriae је грам-позитивна, непокретна бактерија у облику палице. Сојеви који расту у ткиву или старије ин витро културе садрже фине мрље у ћелијским зидовима које омогућавају обезбојавање током бојења по Граму и резултирају варијабилном Грамовом реакцијом. Старије културе често садрже метахроматске грануле (полиметафосфат) које се боје плавкасто-љубичасто метилен плавим. Шећери ћелијског зида укључују арабинозу, галактозу и манозу. Поред тога, може се изоловати токсични 6,6'-естар трехалозе, који садржи коринемиколну и коринемиколенску киселину у еквимоларним концентрацијама. Препознају се три различита типа културе: митис, интермедијус, гравис.
Већини сојева су потребне никотинска и пантотенска киселина за раст; некима су потребни и тиамин, биотин или пимелинска киселина. За оптималну производњу дифтеријског токсина, медијум мора бити допуњен аминокиселинама и мора се оставити са стране.
Још 1887. године, Лефлер је описао изолацију авирулентних (нетоксигених) сојева C. diphtheriae који се нису могли разликовати од вирулентних (токсигених) сојева изолованих од пацијената код здравих особа. Сада је познато да се авирулентни сојеви C. diphtheriae могу претворити у вирулентни фенотип након инфекције и лизогенизације једним од бројних различитих коринебактериофага који носе структурни ген за дифтеријски токсин, tox. Лизогена конверзија авирулентног у вирулентни фенотип може се десити и in situ и in vitro. Структурни ген за дифтеријски токсин није неопходан ни за коринебактериофаг ни за C. diphtheriae. Упркос овом запажању, генетски дрифт дифтеријског токсина није примећен.
Патогенеза
Улазна места инфекције су слузокоже орофаринкса, носа, гркљана, ређе слузокожа очију и гениталија, као и оштећена кожа, ране или опекотине, пеленски осип, незацељена пупчана рана. На улазном месту, дифтеријски коринебактериум се размножава и лучи егзотоксин.
Ексудат богат фибриногеном се излучује и претвара у фибрин под утицајем тромбокиназе која се ослобађа током некрозе епителних ћелија. Формира се фибринозни филм - карактеристичан знак дифтерије.
Асимптоматско назофарингеално носиоцтво је уобичајено у регионима ендемским за дифтерију. Код осетљивих особа, токсигени сојеви изазивају болест реплицирањем и лучењем дифтеријског токсина у назофаринксу или кожним лезијама. Лезија дифтерије је често прекривена псеудомембраном састављеном од фибрина, бактерија и инфламаторних ћелија. Дифтеријски токсин се може протеолитички разложити на два фрагмента: N-терминални фрагмент А (каталитички домен) и фрагмент Б (трансмембрански и домени који се везују за рецепторе). Фрагмент А катализује NAD+-зависну АДП-рибозилацију фактора елонгације 2, чиме инхибира синтезу протеина у еукариотским ћелијама. Фрагмент Б се везује за рецептор на површини ћелије и олакшава испоруку фрагмента А у цитосол.
Заштитни имунитет подразумева антитела на дифтеријски токсин након клиничке болести или на дифтеријски токсин (токсин инактивиран формалдехидом) након имунизације.
Колонизација
Мало се зна о факторима који посредују у колонизацији C. diphtheriae. Међутим, јасно је да фактори који нису производња дифтеријског токсина доприносе вируленцији. Епидемиолошке студије су показале да дати лизотип може да опстане у популацији током дужег временског периода. Касније га може заменити други лизотип. Појава и накнадна доминација новог лизотипа у популацији вероватно је повезана са његовом способношћу да колонизује и ефикасно се такмичи у свом сегменту назофарингеалне еколошке нише. Corynebacterium diphtheriae може да производи неураминидазу, која цепа сијалинску киселину на површини ћелија на њене компоненте пируват и N-ацетилнеураминову киселину. Фактор корде (6,6'-ди-О-миколоил-α, α'-D-трехалоза) је површинска компонента C. diphtheriae, али његова улога у колонизацији људског домаћина није јасна.
Производња дифтеријских токсина
Структурни ген дифтеријског токсина, tox, припада породици блиско сродних коринебактериофага, од којих је β-фаг најбоље проучен. Регулација експресије дифтеријског токсина посредована је репресором активираним гвожђем, DtxR, који је кодиран геномом C. diphtheriae. Експресија токсина зависи од физиолошког стања C. diphtheriae. Под условима у којима гвожђе постаје супстрат који ограничава брзину раста, гвожђе се дисоцира од DtxR, ген токсикодендрон се активира, а дифтеријски токсин се синтетише и секретује у подлогу за култивацију максималним брзинама.
Дифтеријски токсин је необично јак; за осетљиве врсте (нпр. људе, мајмуне, зечеве, заморце) чак 100 до 150 нг/кг телесне тежине је смртоносно. Дифтеријски токсин се састоји од једног полипептидног ланца од 535 аминокиселина. Биохемијска, генетска и рендгенска структурна анализа показују да се токсин састоји од три структурна/функционална домена:
- Н-терминална АДП-рибозилтрансфераза (каталитички домен);
- регион који олакшава испоруку каталитичког домена кроз ћелијску мембрану (трансмембрански домен);
- домен везивања рецептора еукариотских ћелија.
Након благог варења трипсином и редукције под денатуришућим условима, дифтеријски токсин се може специфично раздвојити на својој петљи осетљивој на протеазу на два полипептидна фрагмента (А и Б). Фрагмент А је N-терминална компонента токсина од 21 kDa и садржи каталитичко место за АДП-рибозилацију фактора елонгације 2 (EF-2).
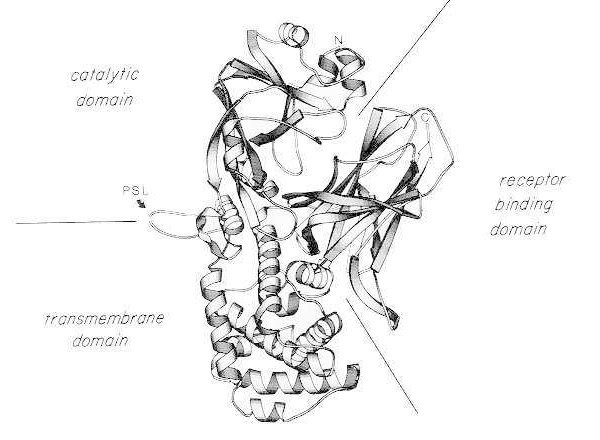
Дијаграм траке рендгенске кристалне структуре мономерног нативног дифтеријског токсина. (модификовано из Bennett MJ, Choe S, Eisenberg D: Domain swapping: Entangling aliances between proteins. Proc Natl Acad Sci, USA, 91: 3127, 1994). Приказани су релативни положаји каталитичких, трансмембранских и домена који се везују за рецептор. Интактни токсин може бити цепан трипсину сличним протеазама на Arg190, Arg192 и/или Arg193, које се налазе у петљи осетљивој на протеазу (PSL). Након редукције дисулфидног моста између Cys186 и Cys201, токсин се може раздвојити на А и Б фрагменте. Приказани су амино-терминус (N) и карбокси-терминус (C) интактног токсина. Тракасти дијаграм је креиран помоћу програма MOLESCRIPT.
C-терминални фрагмент, фрагмент Б, носи трансмембрански и рецептор-везујући домен токсина.
Тровање једне еукариотске ћелије дифтеријским токсином укључује најмање четири различита корака:
- везивање токсина за његов рецептор на површини ћелије;
- груписање наелектрисаних рецептора у обложене јаме и интернализација токсина путем рецептором посредоване ендоцитозе; након закисељавања ендоцитне везикуле помоћу мембрански повезане, АТП-покренуте протонске пумпе,
- уметање трансмембранског домена у мембрану и олакшана испорука каталитичког домена у цитосол, и
- АДП-рибозилација ЕФ-2, што резултира неповратном супресијом синтезе протеина.
Показано је да је један молекул каталитичког домена достављен у цитосол довољан да буде смртоносан за ћелију.
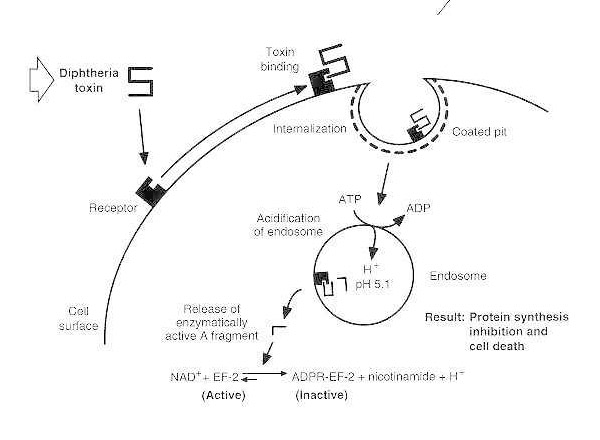
Шематски дијаграм интоксикације дифтеријом осетљиве еукариотске ћелије.
Токсин се везује за рецептор на површини ћелије и интернализује се путем рецептором посредоване ендоцитозе; након закисељавања ендозома, трансмембрански домен се убацује у мембрану везикула; каталитички домен се доставља цитосолу, што доводи до инхибиције синтезе протеина и ћелијске смрти.
Епидемиологија
Пре масовне имунизације становништва САД дифтеријским токсоидом, дифтерија је обично била дечја болест. Значајан аспект масовне имунизације дифтеријским токсоидом је то што се, како се проценат становништва са заштитним нивоима имунитета на антитоксин (≥ 0,01 IU/mL), смањује учесталост изолације токсигених сојева из популације. Данас, у Сједињеним Државама, где је клиничка дифтерија скоро потпуно нестала, изолација токсигених сојева C. diphtheriae је ретка. Пошто субклиничка инфекција више не пружа извор изложености антигену дифтерије и, осим ако се не појача, имунитет на антитоксин опада, велики проценат одраслих (30 до 60%) има нивое антитоксина испод заштитних нивоа и налази се у ризику. У Сједињеним Државама, Европи и Источној Европи, недавне епидемије дифтерије догодиле су се првенствено међу особама које злоупотребљавају алкохол и/или дроге. Унутар ове групе, носиоци токсигеног C. diphtheriae имају умерено висок ниво антитоксичног имунитета. Недавни слом мера јавног здравља у Русији довео је до тога да дифтерија постане епидемија. До краја 1994. године у Русији је пријављено више од 80.000 случајева и више од 2.000 смртних случајева.
Фокалне епидемије дифтерије су скоро увек повезане са носиоцем имунитета који се вратио из региона где је дифтерија ендемска. Заиста, недавне епидемије клиничке дифтерије у Сједињеним Државама и Европи повезане су са путницима који се враћају из Русије и Источне Европе. Токсигени сојеви C. diphtheriae се преносе директно са особе на особу капљицама у ваздуху. Познато је да токсигени сојеви могу директно колонизовати назофарингеалну шупљину. Поред тога, токсигени ген се може индиректно ширити ослобађањем токсигеног коринебактериофага и лизогеном трансформацијом нетоксичног аутохтоног C. diphtheriae in situ. [ 5 ]
Поред одређивања биотипа и лизотипа изолата C. diphtheriae, технике молекуларне биологије сада се могу користити за проучавање епидемија дифтерије. Обрасци варења хромозомске ДНК C. diphtheriae рестрикционим ендонуклеазама коришћени су за проучавање клиничких епидемија, као и употреба клонираних коринебактеријских инсерционих секвенци као генетске сонде.
Шиков тест се годинама користи за процену имунитета на дифтеријски токсин, иако је сада у многим областима замењен серолошким тестом за специфична антитела на дифтеријски токсин. У Шиковом тесту, мала количина дифтеријског токсина (приближно 0,8 нг у 0,2 мл) се убризгава интрадермално у подлактицу (место тестирања), а 0,0124 μг дифтеријског токсина у 0,2 мл се убризгава интрадермално у контролно место. Очитавања се врше након 48 и 96 сати. Неспецифичне кожне реакције обично достижу врхунац након 48 сати. Након 96 сати, еритематозна реакција са могућом некрозом на месту тестирања указује на недовољан антитоксични имунитет за неутрализацију токсина (≤ 0,03 ИУ/мл). Упала и у тестном и у контролном подручју након 48 сати указује на реакцију преосетљивости на препарат антигена.
Обрасци
Коринебактерије дифтерије инфицирају назофаринкс или кожу. Токсигени сојеви производе снажан егзотоксин који може изазвати дифтерију. Симптоми дифтерије укључују фарингитис, грозницу и оток врата или подручја око кожне лезије. Дифтеритичне лезије су прекривене псеудомембраном. Токсин се шири крвотоком до удаљених органа и може изазвати парализу и конгестивну срчану инсуфицијенцију. [ 6 ]
Постоје две врсте клиничке дифтерије: назофарингеална и кутана. Симптоми фарингеалне дифтерије крећу се од благог фарингитиса до хипоксије услед опструкције дисајних путева псеудомембраном. Захваћеност цервикалних лимфних чворова може изазвати јак оток врата (дифтерија биковог врата), а пацијент може развити грозницу (≥ 38°C). Кожне лезије код кутане дифтерије су обично прекривене сиво-смеђом псеудомембраном. Системске компликације опасне по живот, углавном губитак моторичке функције (нпр. отежано гутање) и конгестивна срчана инсуфицијенција, могу се развити као резултат деловања дифтеријског токсина на периферне моторне неуроне и миокард.
Контрола
Контрола дифтерије зависи од адекватне имунизације дифтеријским токсоидом: дифтеријски токсин инактивиран формалдехидом, који остаје антигенски нетакнут. Токсоид се припрема инкубацијом дифтеријског токсина са формалдехидом на 37°C у алкалним условима. Имунизација против дифтерије треба да почне у другом месецу живота серијом од три примарне дозе у интервалима од 4 до 8 недеља, након чега следи четврта доза отприлике 1 годину након последње примарне вакцине. Дифтеријски токсоид се широко користи као компонента вакцине против дифтерије, великог кашља и тетануса (ДПТ). Епидемиолошке студије су показале да је имунизација против дифтерије ефикасна приближно 97%. Иако се масовна имунизација против дифтерије спроводи у Сједињеним Државама и Европи и стопе имунизације деце су адекватне, велики део одрасле популације може имати титре антитела испод заштитних нивоа. Одрасле треба ревакцинисати дифтеријским токсоидом сваких 10 година. Заиста, бустери имунизацију дифтеријско-тетанус токсоидом треба дати путницима у подручја са високим стопама ендемске дифтерије (Централна и Јужна Америка, Африка, Азија, Русија и Источна Европа). Последњих година, употреба високо пречишћених токсоидних препарата за имунизацију смањила је повремене тешке реакције преосетљивости. Бустер имунизацију дифтеријско-тетанус токсоидом треба дати путницима у подручја са високим стопама ендемске дифтерије (Централна и Јужна Америка, Африка, Азија, Русија и Источна Европа). Последњих година, употреба високо пречишћених токсоидних препарата за имунизацију смањила је повремене тешке реакције преосетљивости. Бустер имунизацију дифтеријско-тетанус токсоидом треба дати путницима у подручја са високим стопама ендемске дифтерије (Централна и Јужна Америка, Африка, Азија, Русија и Источна Европа). Последњих година, употреба високо пречишћених токсоидних препарата за имунизацију смањила је повремене тешке реакције преосетљивости.
Иако се антибиотици (као што су пеницилин и еритромицин) користе као део лечења пацијената са дифтеријом, брза пасивна имунизација антитоксином дифтерије је најефикаснија у смањењу смртности. Дуго време полураспада специфичног антитоксина у крвотоку је важан фактор у обезбеђивању ефикасне неутрализације токсина дифтерије; међутим, да би био ефикасан, антитоксин мора да реагује са токсином пре него што може да уђе у ћелију.
Реинжењеринг дифтеријског токсина за развој цитотоксина специфичних за еукариотске рецепторе
Протеински инжењеринг је ново и брзо развијајуће поље у молекуларној биологији; оно комбинује методологије рекомбинантне ДНК и синтезу ДНК у чврстој фази како би се дизајнирали и конструисали химерни гени чији производи имају јединствена својства. Студије односа структуре и функције дифтеријског токсина јасно су показале да је овај токсин протеин са три домена: каталитички, трансмембрански и рецепторски. Било је могуће генетски заменити нативни домен везивања рецептора дифтеријског токсина различитим полипептидним хормонима и цитокинима (нпр. α-меланоцит-стимулишући хормон [α-MSH], интерлеукин (IL) 2, IL-4, IL-6, IL-7, епидермални фактор раста). Добијени химерни протеини или фузиони токсини комбинују специфичност везивања рецептора цитокина са трансмембранским и каталитичким доменима токсина. У сваком случају, показано је да фузиони токсини селективно трују само оне ћелије које носе одговарајући циљни рецептор. Први од ових генетски модификованих фузионих токсина, DAB 389IL-2, тренутно се процењује у клиничким испитивањима на људима за лечење рефракторних лимфома и аутоимуних болести код којих ћелије са високим афинитетом IL-2 рецептора играју важну улогу у патогенези.[ 7 ] Показало се да је примена DAB 389 IL-2 безбедна, добро подношљива и способна да изазове трајну ремисију болести без озбиљних нежељених ефеката. Вероватно је да ће фузиони токсини на бази дифтеријског токсина постати важни нови биолошки агенси за лечење специфичних тумора или болести код којих се могу циљати специфични рецептори на површини ћелија.


 [
[