
Сви иЛиве садржаји су медицински прегледани или проверени како би се осигурала што већа тачност.
Имамо стриктне смјернице за набавку и само линкамо на угледне медијске странице, академске истраживачке институције и, кад год је то могуће, медицински прегледане студије. Имајте на уму да су бројеви у заградама ([1], [2], итд.) Везе које се могу кликнути на ове студије.
Ако сматрате да је било који од наших садржаја нетачан, застарио или на неки други начин упитан, одаберите га и притисните Цтрл + Ентер.
Дијагноза стадијума тока рака простате
Медицински стручњак за чланак
Последње прегледано: 04.07.2025
Клинички се прави разлика између локализованог (Т1-2 , Н0 , М0 ), локално узнапредовалог (Т3-4 , Н0-1 , М0 ) и генерализованог рака (Т1-4 , Н0-1 , М1 ).
Пацијенти са клинички локализованим и локално узнапредовалим стадијумима класификују се према степену ризика (D'Amico A V. et al., 2003):
- низак: стадијум Т 1а-ц; ниво ПСА мањи од 10 μг/мл: Глисонова скала - 2-5; у биопсији - једнострана лезија мања од 50%:
- умерено: стадијум Т 2а; ниво ПСА мањи од 10 нг/мл; Глисонов скор - 3 + 4 = 7; у биопсији - билатерална лезија мања од 50%;
- висок стадијум Т 2б, Т 3а-б; ниво ПСА - 10-20 нг/мл; Глисонова скала - више од 4 + 3 - 7; у биопсији - оштећење више од 50%, перинеурална инвазија;
- веома висок: стадијум Т4 ; ниво ПСА преко 20 нг/мл; Глисонов скор преко 8; биопсија показује лимфоваскуларну инвазију.
Након што је дијагноза разјашњена и утврђен обим процеса (локализован, локално узнапредовао или генерализован), лекар и пацијент се суочавају са избором методе лечења. У савременом друштву, велики значај се придаје квалитету живота пацијената након почетка лечења. Квалитет живота без лечења одговара току основне болести и зависи од прогресије онколошког процеса. Промене у квалитету живота настају углавном након почетка лечења и примене једне од терапијских или хируршких метода. Јасно утврђивање стадијума процеса омогућава не само избор оптималне методе лечења, већ и предвиђање даљег тока болести.
Одређивање нивоа ПСА у комбинацији са клиничком сликом рака простате и градацијом тумора према Глисоновој скали значајно повећава информативни садржај сваког од наведених индикатора у утврђивању патолошког стадијума рака. АВ Партин и др. (1997) предложили су прогностичке табеле које омогућавају предвиђање даљег ширења тумора, избора методе лечења, степена радикалности и прогнозе ефикасности лечења.
За процену ширења тумора, најчешће коришћене методе су DRE, TRUS, одређивање нивоа PSA и сцинтиграфија костију. По потреби се прописују компјутеризована томографија (CT) или магнетна резонанца (MRI) и рендгенски снимак грудног коша.
Било која од метода снимања је осмишљена да одреди стадијум и процени ефикасност лечења. Након верификације дијагнозе, уролог мора разјаснити запремину примарног тумора, његове границе, инвазивни или метастатски потенцијал тумора. Сви ови индикатори су од великог значаја за прогнозу болести и избор методе лечења.
Примарни тумор (Т)
Пре свега, потребно је утврдити да ли је тумор ограничен на простату (Т 1-2 ) или се протеже изван капсуле (Т 3-4 ). Дигитални преглед често не дозвољава процену ширења тумора. Према неким подацима, резултати ДРЕ одговарају резултатима хистолошког прегледа код мање од 50% пацијената. Међутим, детаљнији преглед је индикован само приликом одлучивања о радикалном лечењу.
Ниво ПСА може одражавати обим тумора, али не омогућава тачно одређивање морфолошког стадијума. Комбинација нивоа ПСА, Глисоновог индекса и података палпације омогућава боље предвиђање морфолошког стадијума него сваки од ових параметара засебно. Вредност слободног ПСА је контроверзна: у једној студији, одређивање садржаја слободног ПСА помогло је да се разјасни стадијум код локализованих тумора, али друге студије то нису потврдиле. Само детаљне студије ће помоћи у решавању овог питања.
Трансректални ултразвук се најчешће користи за испитивање стања простате. Ова метода може да открије само 60% тумора и не показује увек инвазију капсуле. Скоро 60% пацијената са стадијумом Т3 . Ултразвук указује на ређи процес. Ултразвучни знаци инвазије капсуле су испупчење, неравнина и руптура контуре жлезде. Инвазија туморских ћелија у семене кесице је лош прогностички знак, али су информације о њему изузетно важне за избор методе лечења. Приликом извођења ТРУС-а, треба обратити пажњу на ехоструктуру кесица (хиперехогеност), њихову асиметрију, деформацију и ширење. Такође, оштећење семенских кесица је назначено губитком округлости и збијањем у основи жлезде. Ови знаци су прилично субјективни, па је неприкладно у потпуности се ослањати на ултразвучне податке. Инвазија семенских кесица указује на висок ризик од локалног рецидива и метастаза, а њихова биопсија је индикована ради разјашњења (пре операције). Преглед не треба започињати овом процедуром, али ако је ризик од инвазије висок и избор лечења зависи од резултата биопсије, онда је његова примена оправдана. Негативан резултат не искључује микроскопску инвазију. По правилу, биопсија семенских кесица се спроводи у клиничком стадијуму Т 2б и вишем и садржај ПСА је већи од 10 нг/мл. Резултат се сматра позитивним ако барем једна биопсија из базе простате садржи туморске ћелије. Не само додатне студије, већ и темељна анализа резултата примарне биопсије омогућавају повећање тачности клиничког одређивања стадијума (број и обим туморских жаришта, инвазија капсуле играју улогу). Степен диференцијације је такође важан: са Глисоновим индексом мањим од 6, тумор је локализован у 70% случајева.
Проток крви у простати са раком је већи него у нормалној жлезди или са њеном хиперплазијом. Након кастрације, интензитет протока крви у жлезди је смањен. Развој ехо-доплерографских мапа за дијагнозу и праћење рака простате је обећавајући, али тренутно нема поузданих података о употреби ехо-доплерографије у одређивању стадијума локалног процеса. Могуће је користити ову методу за добијање додатног материјала током циљане биопсије из жаришта патолошке васкуларизације.
Резултати визуелизације рака простате директно зависе од техничке опремљености клинике и искуства специјалисте. Зато све савремене методе визуелизације не играју одлучујућу већ разјашњавајућу улогу, а избор методе лечења заснива се на комбинацији података клиничког прегледа и инструменталних студија.
МРИ има најбоље могућности за визуелизацију структуре простате. Савремени стандард за испитивање карличних органа МРИ методом је употреба ендоректалног сензора, који омогућава добијање слике са највећом могућом просторном резолуцијом од 0,5-1 мм. Убацивање ваздуха у ендоректални сензор омогућава јасну визуелизацију капсуле простате, ректопростатских углова и Денонвилијерове ректопростатске фасције. Употреба ендоректалног сензора у МРИ не ограничава визуелизацију регионалних лимфних чворова (до нивоа бифуркације абдоминалне аорте). Рак простате карактерише низак интензитет сигнала на Т-пондерисаним сликама на позадини сигнала високог интензитета из непромењене периферне зоне жлезде. Неправилан облик, дифузно ширење са масним ефектом, нејасне и неравне контуре су морфолошке карактеристике жаришта ниског интензитета сигнала у периферној зони простате, што указује на неопластичну природу лезије. Приликом извођења динамичког контрастирања, жаришта рака брзо акумулирају контрастно средство у артеријској фази и брзо га уклањају, што одражава степен ангиогенезе и, сходно томе, степен малигнитета тумора. Низак интензитет сигнала је такође карактеристичан за жаришта постбиопсијских хеморагија, простатитис, стромалну бенигну хиперплазију неутралне зоне жлезде, фиброзно-цикатрицијалне промене, фибромускуларну хиперплазију, последице хормонске или радиотерапије. МРИ без динамичког контрастирања не дозвољава поуздану диференцијацију већине наведених промена и болести.
Као што је горе наведено, један од главних задатака било које методе снимања рака простате јесте одређивање запремине лезије жлезде и ширења тумора изван капсуле. Одређивање запремине тумора је важно за прогнозу. Запремина тумора мања од 4 цм³ указује на удаљене метастазе, а 12 цм³ указује на изузетно високу вероватноћу метастаза. Према истраживањима, тачност МРИ у откривању жаришта неопластичних лезија простате креће се од 50 до 90%. Осетљивост МРИ у одређивању локализације рака простате је око 70-80%, док се микроскопски жаришта рака (фокуси) не могу открити помоћу МРИ.
Најважнија предност ендоректалне МРИ је могућност локализације неопластичних лезија у подручјима неприступачним другим дијагностичким методама и разјашњење природе и правца раста тумора. На пример, МРИ омогућава откривање неопластичних лезија у предњим деловима периферне зоне простате, неприступачним трансректалном биопсијом. Генерално, МРИ значајно допуњује податке ДРЕ и ТРУС о локализацији тумора.
Ендоректална МРИ омогућава визуелизацију капсуле жлезде, васкуларно-нервних снопова, семених кесица, врха жлезде, перипростатичког венског плексуса и одређивање локалне преваленције тумора жлезде. Треба нагласити да се пенетрација капсуле сматра микроскопским знаком и да чак ни савремени МРИ уређаји (ендоректална завојница) нису у могућности да пруже такве информације. Могуће је само добити податке о расту изван капсуле жлезде.
Дијагностички критеријуми за екстракапсуларно проширење помоћу МРИ:
- присуство екстракапсуларног тумора;
- неуједначена контура жлезде (деформација, угаоност);
- асиметрија неуроваскуларних снопова;
- облитерација ректопростатичких углова;
- широк контакт тумора са капсулом.
Највећа специфичност (до 95-98%) и тачност резултата МРИ постижу се приликом испитивања пацијената са средњим или високим ризиком од екстракапсуларне инвазије. Сматра се да екстракапсуларна инвазија (према подацима МРИ) указује на неодговарање хируршког лечења и неповољну прогнозу болести. Хормонска или радиотерапија не утичу на тачност откривања екстракапсуларног ширења тумора простате. Главна тешкоћа у откривању жаришта рака и екстракапсуларног ширења тумора је велика варијабилност интерпретације томограма од стране различитих специјалиста. Примарни задатак специјалисте радиодијагностике је да постигне високу дијагностичку специфичност (чак и на рачун осетљивости) како не би лишио операбилне пацијенте шансе за радикално лечење.
Сличност густине канцерогеног, хиперпластичног и нормалног ткива простате на ЦТ-у чини ову методу мало корисном за процену локалног ширења тумора. Инвазија у семене кесице је важнија од инвазије у капсуле, али чак и у овом случају ЦТ пружа информације само у узнапредовалим случајевима. Међутим, ова метода се активно користи за обележавање подручја удара пре радиотерапије.
Спори развој радиодијагностике у нашој земљи довео је до касне дијагнозе рака простате и, последично, до недовољне распрострањености радикалних метода лечења рака простате (на пример, простатектомија), ниске доступности савремених томографа и одсуства одговарајућих програма обуке за специјалисте радиодијагностике и урологе. Упркос чињеници да су ЦТ и МРИ сада широко распрострањени, ниво опремљености ординација и образовања специјалиста радиодијагностике није довољан да би добијене информације постале одлучујуће у избору методе лечења пацијената са раком простате.
Регионални лимфни чворови (Н)
Регионалне лимфне чворове треба проценити само када то директно утиче на стратегију лечења (обично приликом планирања радикалног лечења). Високи нивои ПСА, тумори Т2ц -Т3а, лоша диференцијација и перинеурална инвазија повезани су са високим ризиком од метастаза лимфних чворова. Процена статуса лимфних чворова на основу нивоа ПСА сматра се недовољном.
Само лимфаденектомија (отворена или лапароскопска) пружа потребне информације. Недавне студије проширене лимфаденектомије показале су да рак простате не погађа увек обтураторне лимфне чворове. Код асимптоматских тумора и нивоа ПСА мањих од 20 кг/мл. ЦТ потврђује увећане лимфне чворове само у 1% случајева. Употреба МРИ или ЦТ је оправдана у случајевима високог ризика од метастаза, јер специфичност ових метода достиже 93-96%. Међутим, чак и позитиван резултат при њиховој употреби може бити лажан, а само пункција сумњивог лимфног чвора омогућава одбијање лимфаденектомије. Према ретроспективној анализи, величина лимфног чвора не указује увек на присуство метастаза у њему; асиметрија захваћених лимфних чворова сматра се информативнијим знаком. Тренутно се само 2-3% пацијената који су подвргнути радикалној простатектомији због локализованог рака простате дијагностикује са метастазама у лимфне чворове на основу постоперативног хистолошког прегледа.
Позитронска емисиона томографија (ПЕТ) и сцинтиграфија са обележеним антителима се препоручују као методе за откривање метастаза у лимфним чворовима, али је њихова употреба и даље ограничена због недовољне осетљивости.
Партинови номограми (2001) могу се користити за процену ризика од захваћености регионалних лимфних чворова. Номограми су математички алгоритми који се користе за одређеног пацијента или групу пацијената. Ове табеле омогућавају одређивање вероватноће локалног ширења тумора (на капсулу, семене кесице) и захваћености лимфних чворова на основу клиничког стадијума, нивоа ПСА и Глисоновог индекса. Конкретно, оне омогућавају идентификацију групе пацијената са ниском (мање од 10%) вероватноћом метастаза лимфних чворова (са нивоом ПСА преко 20 нг/мд, стадијумом Т 1-2а и Глисоновим индексом 2-6); у овој групи, стање лимфних чворова можда неће бити прецизирано пре радикалног лечења. Ризик од метастаза лимфних чворова може се проценити и откривањем подручја тумора са израженом анаплазијом (4-5 поена): ако се таква подручја пронађу у четири или више биопсија или преовлађују у најмање једној биопсији, ризик достиже 20-45%. Код осталих пацијената не прелази 2,5%. Додатни преглед у таквим случајевима није потребан.
Удаљене метастазе (М)
Код 85% пацијената који умиру од рака простате откривају се лезије аксијалног скелета. Коштане метастазе настају услед продора ћелија рака у коштану срж са крвотоком, што доводи до раста тумора и лизе коштаних структура. Преваленција коштаних метастаза утиче на прогнозу, а њихово рано откривање упозорава лекара на могуће компликације. У 70% случајева, метастазе су комбиноване са повећањем активности коштаног изоензима алкалне фосфатазе (АЛП). Одређивање активности АЛП и нивоа ПСА у великој већини случајева омогућава нам да откријемо коштане метастазе. Према мултиваријантној анализи, на ове индикаторе утиче само број коштаних метастаза. Важно је да активност коштаног изоензима АЛП тачније одражава степен оштећења костију него ниво ПСА.
Сцинтиграфија се сматра најосетљивијом методом за откривање коштаних метастаза (супериорнија је у односу на радиографију и одређивање активности алкалне и киселе фосфатазе). Технецијум дифосфонати се боље користе као радиофармацеутски лек, јер је њихова акумулација у костима много активнија него у меким ткивима. Показана је корелација између полуквантитативне процене оштећења костију и преживљавања. Детекција удаљених метастаза је могућа у било ком органу. Најчешће се јављају у нерегионалним лимфним чворовима, плућима, јетри, мозгу и кожи. У случају одговарајућих тегоба и симптома, за њихово откривање се користе рендгенски снимак грудног коша, ултразвук, ЦТ и МРИ. Тактика код сумње на коштане метастазе је представљена на дијаграму.
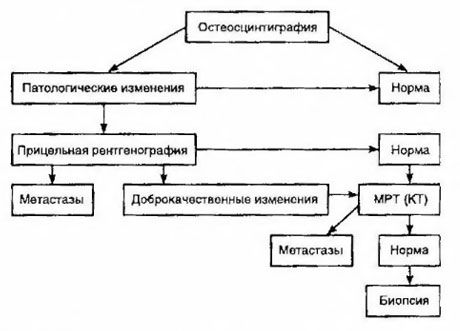
Најпоузданији лабораторијски индикатор који помаже у одређивању степена метастаза је ниво ПСА. Показано је да је његово повећање преко 100 нг/мл једини параметар који поуздано указује на удаљене метастазе. Одређивање нивоа ПСА смањује број пацијената којима је потребна сцинтиграфија костију. Вероватноћа откривања коштаних метастаза са смањењем нивоа ПСА је веома мала. У одсуству тегоба и почетном садржају ПСА мањем од 20 нг/мл, откривању високо и умерено диференцираних тумора, сцинтиграфија се може избећи. Истовремено, у случају слабо диференцираних тумора и инвазије капсуле, индикована је сцинтиграфија (без обзира на ниво ПСА).


 [
[