
Сви иЛиве садржаји су медицински прегледани или проверени како би се осигурала што већа тачност.
Имамо стриктне смјернице за набавку и само линкамо на угледне медијске странице, академске истраживачке институције и, кад год је то могуће, медицински прегледане студије. Имајте на уму да су бројеви у заградама ([1], [2], итд.) Везе које се могу кликнути на ове студије.
Ако сматрате да је било који од наших садржаја нетачан, застарио или на неки други начин упитан, одаберите га и притисните Цтрл + Ентер.
Беснило код деце
Медицински стручњак за чланак
Последње прегледано: 04.07.2025
Беснило, или хидрофобија, је акутна вирусна болест која се преноси угризом заражене животиње, са оштећењем нервног система и развојем тешког енцефалитиса са смртним исходом.
Епидемиологија
Вирус беснила, пошаст јавног здравља од давнина, тренутно узрокује приближно 59.000 људских смртних случајева сваке године, од којих се скоро све преносе уједима паса. Ово има значајан економски утицај на земље у развоју, посебно у Африци и Азији, које могу да поднесу најмање таквих губитака. Међутим, упркос стопи смртности од скоро 100%, беснило код паса је болест која се може у потпуности спречити, а историјски примери искорењивања беснила код паса у развијеном свету то потврђују. [ 1 ]
Узроци беснило
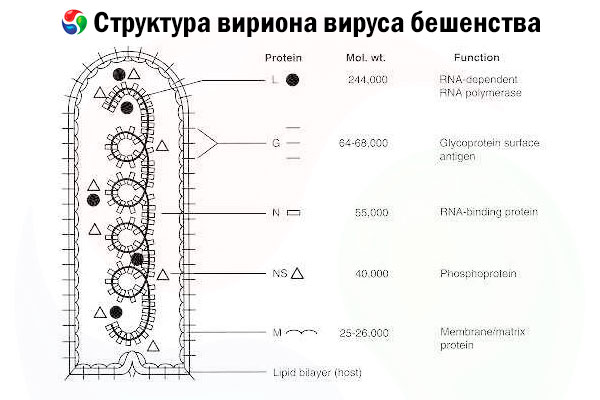
Узрочник је вирус беснила (RV), вирус негативног ланца РНК из породице рабдовируса, величине приближно 60 nm × 180 nm.
Састоји се од унутрашњег протеинског језгра, или нуклеокапсида, који садржи нуклеинску киселину, и спољашње мембране, двослоја који садржи липиде и прекривен је трансмембранским гликопротеинским шиљцима. Има релативно једноставну модуларну структуру генома и кодира пет структурних протеина:
- РНК-зависна РНК полимераза (L),
- нуклеопротеин (N),
- фосфориловани протеин (П),
- матрични протеин (М) и
- гликопротеин спољашње површине (G).
N, P и L протеини заједно са геномском РНК формирају рибонуклеопротеински комплекс. G је једини антиген вируса ротавируса способан да индукује производњу антитела која неутралишу вирус ротавируса, која су главни имуни ефектори против смртоносне инфекције вирусом ротавируса. С друге стране, показало се да је рибонуклеопротеински комплекс главни антиген вируса ротавируса способан да индукује CD4+ Т ћелије, што може побољшати производњу антитела која неутралишу вирус ротавируса путем интраструктурног препознавања антигена.[ 2 ] Рибонуклеопротеински комплекс може играти важну улогу у успостављању имунолошке меморије и дугорочног имунитета.[ 3 ]
Класификација и типови антигена
Род Lyssavirus обухвата вирус беснила и антигенски и генетски сродне вирусе беснила: вирусе слепих мишева Лагос, Мокола и Дувенхаге, као и два претпостављена подтипа европских вируса слепих мишева. Студије унакрсне заштите указују да животиње имунизоване традиционалним вакцинама против беснила можда неће бити у потпуности заштићене када се заразе другим вирусима слепих мишева.
Вируси беснила могу се класификовати као фиксни (адаптирани пасажом у животињама или ћелијској култури) или улични (дивљи тип). Употреба моноклонских антитела и генетског секвенцирања за диференцијацију уличних вируса беснила помогла је у идентификацији вирусних варијанти које потичу из главних резервоара домаћина широм света и у сугерисању вероватних извора изложености људи када је историја дефинитивног уједа животиње иначе одсутна код пацијента.[ 8 ]
Патогенеза
Главни резервоар и извор инфекције међу дивљим животињама су вукови, лисице, шакали, слепи мишеви, а међу домаћим животињама - пси и мачке, ретко - коњи, говеда, свиње, пацови итд. Пренос инфекције са особе на особу, иако је могућ, изузетно је редак. Ово је типична зоонотска инфекција. Људи се заразе беснилом углавном од паса.
Након што човека угризе болесна животиња, вирус се размножава у мишићном ткиву на месту уједа, а затим, стигавши до завршетака сензорних периферних нерава, шири се центрипетално, доспевајући до моторних неурона. Време потребно за кретање вируса и захваћање мозга зависи од места уједа. У случају тешких уједа главе и лица, вирус може доспети до централног нервног система за 15-20 дана, а у случају мањег оштећења коже трупа и удова и, последично, мале дозе патогена, процес премештања вируса у централни нервни систем може бити одложен неколико месеци или чак и до 1-1,5 година. Након што стигне до централног нервног система, вирус се фиксира у ткивима мозга и кичмене мождине, углавном у неуронима продужене мождине, Амоновог рога и базе мозга. У кичменој мождини, највише су погођени задњи рогови. Из централног нервног система, вирус центрифугално дуж нервних стабала доспева до пљувачних жлезда, где се размножава и излучује пљувачком.
Концепти у патогенези беснила
Вирус беснила има широк спектар домаћина и може заразити скоро све сисаре. Иако је пријављено неколико путева преношења вируса беснила, природна инфекција се најчешће јавља путем угриза. Поред угриза, конзумирање лешева заражених вирусом беснила може подстаћи инфекцију вирусом беснила код арктичких лисица, а контакт вируса беснила са слузокожом је утврђен као још један могући пут преношења.[ 9 ] У неким необичним околностима, као што је случајно испуштање вируса беснила као аеросола у лабораторији или вируса беснила као аеросола у пећинама насељеним великим бројем слепих мишева,[ 10 ] може доћи до преноса аеросола.
Још увек није јасно да ли се сојеви вируса уличног ротавируса и вируса ротавируса адаптираних на мишеве или на културу ткива реплицирају на месту инокулације пре него што уђу у ЦНС. Док је експериментална интрамускуларна инфекција младих хрчака или ракуна вирусом уличног ротавируса открила репликацију вируса у ћелијама попречно-пругастих мишића пре него што је вирус напао аксоне моторних неурона преко неуромускуларних спојева,[ 11 ],[ 12 ] интрамускуларна инфекција мишева вирусом CVS-24 вирусом ротавируса адаптираним на мишеве показала је да вирус ротавируса мигрира директно у ЦНС без претходне репликације на месту инокулације.[ 13 ] Једном када се нађе у завршецима немијелинизованих аксона, вирус ротавируса се ретроградно транспортује до тела ћелије.
Недавна открића указују на то да транспорт аксонских везикула може представљати кључну стратегију за кретање вириона на велике удаљености у аксонима.[ 14 ] Процењено је да РВ мигрира унутар аксона брзином од 3 мм/х.[ 15 ] Инфекција се затим шири кроз ланац неурона повезаних синаптичким везама. Међутим, тачан механизам који подстиче транссинаптичко ширење још увек није познат. Након инфекције мозга, вирус се центрифугално шири на периферни и аутономни нервни систем у многим периферним органима.[ 16 ] У последњој фази циклуса инфекције, РВ мигрира у пљувачне жлезде; након репликације у мукогеним ацинарним ћелијама, ослобађа се у пљувачку и спреман је за пренос на следећег домаћина.[ 17 ]
Што се тиче патологије изазване вирусом беснила, апоптотска ћелијска смрт је предложена као потенцијални патогени механизам у експерименталним моделима беснила код мишева заражених фиксним сојем вируса беснила.[ 18 ] Патогени механизам који може допринети дубокој дисфункцији ЦНС-а карактеристичној за беснило може бити оштећена неуронска функција. Показало се да је експресија гена значајно смањена у неуронима зараженим вирусом беснила, што резултира општом супресијом синтезе протеина,[ 19 ] а неколико студија је показало оштећену неуротрансмисију након инфекције вирусом беснила. Ђијанг је показао да је везивање антагониста ацетилхолинског рецептора за инфициране хомогенате мозга пацова смањено у поређењу са контролама.[ 20 ] Оштећено ослобађање и везивање серотонина, неуротрансмитера који учествује у контроли циклуса спавања, перцепције бола и понашања, такође је примећено у мозгу пацова заражених вирусом беснила. [ 21 ], [ 22 ] Поред утицаја на неуротрансмисију, инфекција десне коморе може утицати и на јонске канале. Инфициране ћелије неуробластома миша показују смањену функционалну експресију напонски зависних натријумових канала, што може спречити акционе потенцијале и на крају довести до функционалног оштећења. [ 23 ]
Поред одсуства озбиљних патолошких лезија у ЦНС-у, већина случајева беснила код људи не изазива имуни одговор 7 до 10 дана након појаве клиничких знакова. Ове дубоке разлике између патогенезе беснила и патогенезе већине других вирусних или бактеријских инфекција ЦНС-а додатно су поткрепљене чињеницом да је имуносупресија или неефикасна или штетна за исход беснила.[ 24 ] Низак ниво имуног одговора који се често примећује код жртава беснила је загонетан јер се не може објаснити слабом имуногеношћу антигена РВ. У ствари, РВ Г и нуклеокапсидни протеин су снажни Б- и Т-ћелијски антигени када се примењују парентерално.[ 25 ] Могуће објашњење за низак степен имуног одговора против РВ код људи или животиња са беснилом може бити да РВ инфекција ЦНС-а изазива имуносупресију,[ 26 ] и предложено је да РВ користи субверзивну стратегију која укључује спречавање апоптозе и уништавање Т ћелија које инвазирају.[ 27 ]
Атенуирани сојеви РВ који су адаптирани на ненеуронске ћелије значајно се разликују од патогених сојева уличног РВ по својој неуроинвазивности, што се односи на њихову способност да нападну ЦНС са периферних места. У том смислу, сојеви РВ адаптирани на културу ткива или немају или имају само ограничену способност да нападну ЦНС са периферних места, док су сојеви уличног РВ или сојеви РВ адаптирани на мишеве, као што је CVS-24, веома инвазивни.[ 28 ] Кључни фактори укључени у неуроинвазију РВ укључују апсорпцију вируса, аксонски транспорт, транссинаптичко ширење и брзину репликације вируса.
До недавно, наше знање о патогенези РВ је било ограничено и заснивало се првенствено на дескриптивним студијама уличних сојева РВ или експерименталним инфекцијама са атенуираним сојевима адаптираним у лабораторији. Појава технологије реверзне генетике омогућила нам је да идентификујемо вирусне елементе који одређују патогени фенотип РВ и да боље разумемо механизме укључене у патогенезу беснила.
Идентификација вирусних елемената који контролишу стицање, ширење и репликацију вируса беснила
- Вирусни елементи укључени у хватање вируса
Инфекција ротавирусом почиње везивањем вируса за претпостављени ћелијски рецептор. Иако је неколико молекула на површини мембране предложено као рецептори ротавируса, укључујући никотински ацетилхолински рецептор,[ 29 ] молекул адхезије неуронских ћелија[ 30 ] и рецептор неуротрофина ниског афинитета p75 NTR,[ 31 ] још увек није јасно да ли ови молекули заправо играју улогу у животном циклусу вируса беснила. У том контексту, недавно је показано да интеракција ротавируса G–p75 NTR није потребна за инфекцију примарних неурона ротавирусом.[ 32 ] Након везивања за рецептор, ротавирус се интернализује путем адсорптивне или рецептор-посредоване ендоцитозе.[ 33 ] Окружење са ниским pH унутар ендозомалног одељка затим индукује конформационе промене у ротавирусу G које покрећу фузију вирусне мембране са ендозомалном мембраном, чиме се ослобађа RNP у цитоплазму.[ 34 ] Код вируса, ротавирус G игра кључну улогу у апсорпцији вируса, највероватније кроз интеракције са претпостављеним ћелијским рецепторима који олакшавају брзу апсорпцију. У том смислу, показано је да патогеност сојева РВ адаптираних на културу ткива (нпр. ERA, HEP и CVS-11) корелира са присуством детерминанте која се налази на антигеном месту III G протеина. [ 35 ] Мутација Arg → Gln на позицији 333 на овом антигеном месту ERA G протеина резултирала је седмоструким кашњењем у интернализацији Gln333 РВ варијанте у поређењу са варијантом дивљег типа. Мутација Asn194→Lys194 у RV G, која објашњава поновну појаву патогеног фенотипа, била је повезана са значајним смањењем времена интернализације.[ 36 ] Штавише, експерименти са химерним RV показали су да је време потребно за интернализацију RV вириона значајно повећано, а патогеност снажно смањена након замене G гена високо патогеног SB RV соја, који је изведен из cDNA клона сребрног соја RV-18, повезаног са слепим мишевима,[ 37 ] са геном високо атенуираног SN соја, који је изолован из cDNA клона вакцинског соја SAD B19 RV.[ 38 ] Заједно, ови подаци подржавају идеју да је кинетика апсорпције вируса, која је функција RV G, главни фактор патогености RV.
- Вирусни елементи укључени у ширење и преношење вируса
Јединствено својство вируса беснила је његова способност ширења из ћелије у ћелију. Запажање да варијанта Gln333 ERA губи pH-зависну активност ћелијске фузије in vitro [ 39 ] и показује знатно смањену способност ширења из ћелије у ћелију [ 40 ] сугерише да RV G такође игра кључну улогу у ширењу из ћелије у ћелију и самим тим у преносу вируса, вероватно кроз своју фузиогену активност. Ову могућност додатно поткрепљује налаз да је брзина ширења патогеног RV ревертанта SPBNGAK скоро двоструко већа од оне утврђене за непатогену варијанту SPBNGA. Занимљиво је да је мутација Asn 194 → Lys 194 у G SPBNGAK изазвала померање pH прага за мембранску фузију на виши pH, што подржава хипотезу да је виши pH праг за мембранску фузију повезан са повећаним ширењем вируса. [ 41 ]
Студије транснеуронских индикатора инфекције ротавирусом код пацова [ 42 ] и резус мајмуна [ 43 ] показале су да вирус беснила мигрира искључиво у ретроградном смеру у аксонима. Иако је неколико протеина ротавируса укључено у механизме неуронског транспорта, чини се да ротавирус G игра доминантну улогу у транснеуронском ширењу инфекције ротавирусом. На пример, док периферна инфекција вирусом инфективне анемије коња (EIAV) псеудотипизованим са RV G доводи до преноса вируса у кичмену мождину, исти EIAV псеудотипизован са вирусом везикуларног стоматитиса G није успео да уђе у нервни систем. [ 44 ] Штавише, утврђено је да је ширење вируса мутанта ERA G Arg 333 → Gln 333 у ЦНС-у знатно смањено у поређењу са мутантом дивљег типа, што додатно сугерише функцију интактног ротавируса G у транссинаптичком ширењу. Међутим, најубедљивији доказ за важну улогу RV G у транссинаптичком транспорту долази од интракранијалне инфекције мишева рекомбинантним G-дефицијентним RV вирусом, што је показало да је инфекција остала ограничена на неуроне на месту инокулације без икаквих доказа о ширењу на секундарне неуроне.[ 45 ] Међутим, вероватно је да поред RV G, RV M такође игра улогу у ширењу вируса, а самим тим и у транссинаптичком транспорту. У том смислу, показано је да је ширење химерне SN-BMBG RV варијанте, која садржи и M и G из високо патогеног SB, било значајно веће од ширења химерне SN-BG или SN-BM варијанте, које садрже G и M из SB, респективно, што сугерише да оптимална интеракција M са G може играти важну улогу у ширењу вируса од ћелије до ћелије. [ 46 ] Пошто RV M подржава пупљење вируса, [ 47 ] вероватно је да је ефикасније ширење химерне варијанте RV SN-BMBG последица оптималног пупљења вируса на постсинаптичкој мембрани.
Недавне студије су показале да интеракција између RV P и динеинског лаког ланца повезује RV RNP са транспортним системом ћелије домаћина, чиме олакшава ретроградни аксонски транспорт вируса.[ 48 ],[ 49 ] Међутим, периферна инфекција одраслих мишева показала је да делеција LC8 везујућег домена RV P не спречава улазак вируса у ЦНС, што сугерише да RV протеин није директно укључен у ретроградно аксонско ширење RV.[ 50 ]
- Вирусни елементи који контролишу репликацију вируса
За разлику од многих других вируса, као што је вирус грипа, патогеност рабдовируса је обрнуто пропорционална брзини синтезе вирусне РНК и производње инфективних вирусних честица. Поређење нивоа вирусне мРНК и геномске РНК коју производе различити химерни вируси сугерише да су транскрипција и репликација вирусне РНК регулисане вишеструким факторима, укључујући РВ М, који је идентификован као транс-активни фактор који посредује у преласку са почетних високих нивоа синтезе мРНК на синтезу геномске РНК.[ 51 ] Штавише, М из свих рабдовируса је у стању да искључи експресију вирусних гена везивањем за РНП, што резултира формирањем високо кондензоване структуре сличне кичми која није у стању да подржи синтезу РНК.
Да би се идентификовали други вирусни елементи који контролишу патогеност регулисањем вирусне репликације, 5' терминалне секвенце високо патогеног SB соја су постепено замењене секвенцама из високо атенуираног SN вакцинског соја, што је резултирало рекомбинантним вирусима SB2 (терминална секвенца [TS] + L), SB3 (TS + L + псеудоген [Ψ]), SB4 (TS + L + Ψ + G) и SB5 (TS + L + Ψ + G + M). Интрамускуларна инфекција са родитељским SB и SN вирусима и химерним RV SB2, SB3, SB4 и SB5 изазвала је највеће стопе смртности код SB-инфицираних мишева и није дошло до морбидитета или смртности код SN-инфицираних мишева. Замена TS, L и SB одговарајућим елементима из SN резултирала је умереним смањењем морбидитета и смртности, а додатна размена G или G плус M снажно је смањила или потпуно укинула вирусну патогеност.
Фенотипска карактеризација ових дивљег типа и химерних ротавируса у култури ткива открила је да је патогеност датог ротавируса обрнуто корелирана са његовом способношћу репликације у неуронским ћелијама. Иако се SB реплицирао на нивоима скоро 1000 пута нижим од SN, а замена TS, L и у SB нивоима SN имала је мали утицај на кинетику раста вируса, додатна замена G или G плус M из SB одговарајућим SN генима резултирала је повећањем производње вируса за 1 логаритам, што сугерише да кинетику репликације вирусне РНК, као и производњу вирусних честица у великој мери контролише G протеин ротавируса. Овај закључак поткрепљују подаци добијени са G варијантама ротавируса које се разликују за једну аминокиселину у својим G протеинима. Патогена варијанта вируса беснила SPBNGAK 194 произвела је титар вируса у NA ћелијама који је био 1 log нижи од оног који је произвела непатогена варијанта SPBNGAN 194, а анализа PCR у реалном времену показала је да су стопе транскрипције и репликације вирусне РНК у NA ћелијама зараженим SPBNGAK биле 5 и 10 пута веће него у NA ћелијама зараженим SPBNGAK.[ 52 ] Даљи докази за инверзну корелацију између патогености и брзине синтезе вирусне РНК и производње вирусних честица пружили су мишеви заражени химерним рекомбинантним вирусима код којих су G и M гени атенуираног SN соја замењени генима високо патогеног SB соја. Ови експерименти су открили значајно повећање патогености родитељског SN соја који носи RV G у односу на патогени SB сој. Патогеност је додатно повећана када су и G и M из SB уведени у SN.
Супституција G или M или оба у SN одговарајућим генима из SB била је повезана са значајним смањењем брзине производње вирусних честица, као и брзине синтезе вирусне РНК. Ови подаци указују да и G и M играју важну улогу у патогенези RV регулишући вирусну репликацију. Откриће да супституција G или G плус M у SN са G или G плус M из SB доводи до умереног до јаког смањења транскрипције и репликације вирусне РНК, респективно, док супституција самог M у SN са M из SB доводи до јаког повећања транскрипције и репликације вирусне РНК, указује да RV G такође има важну регулаторну функцију у транскрипцији/репликацији вирусне РНК, било сам или кроз интеракцију са M протеином. Механизам којим RV G ген контролише синтезу вирусне РНК није познат. Одређене нуклеотидне секвенце унутар RV G гена, као што су оне које укључују кодоне за Arg333 и Lys 194, идентификоване су као мете за ћелијске miRNA. Показано је да препознавање мете од стране ћелијских miRNA може довести до позитивне или негативне регулације вирусне репликације. [ 53 ] Супституције Arg 333 → Glu 333 или Lys 194 → Ser 194 унутар секвенце гена RV G доводе до укидања циљних секвенци miRNA, што је заузврат повезано са значајним повећањем брзине синтезе вирусне РНК [Faber M, Thomas Jefferson University, PA, USA, необјављени подаци], што сугерише да miRNA ћелија домаћина такође играју важну улогу у регулацији репликације RV, као што је показано за друге РНК вирусе, укључујући вирус везикуларног стоматитиса и HCV. [ 54 ], [ 55 ]
Регулација репликације вируса изгледа да је један од важних механизама укључених у патогенезу РВ. Да би избегли имуни одговор и сачували интегритет неуронске мреже, патогени сојеви РВ, али не и атенуирани сојеви, могу регулисати своју брзину раста. Нижа стопа репликације вероватно користи патогеним сојевима РВ тако што очувава неуронску структуру коју ови вируси користе да би доспели до ЦНС-а. Друго објашњење за нижу стопу репликације патогеног РВ је да, како би избегао рано откривање од стране имуног система домаћина, вирус одржава минималне нивое експресије својих антигена.
Веза између експресије RV G, апоптозе и патогености
Добро је познато да сојеви вируса беснила са улице, који су значајно патогенији од сојева адаптираних на културу ткива, експресују веома ограничене нивое G и не индукују апоптозу до касно у инфективном циклусу, што сугерише да је патогеност одређеног вирусног соја обрнуто корелирана са експресијом RV G и способношћу да индукује апоптозу.[ 56 ] Директни докази за корелацију између нивоа експресије G и степена апоптозе добијени су са рекомбинантним RV SPBNGA-GA, који је носио два идентична G гена и прекомерно експресовао RV G.[ 57 ] Морфолошке студије неуронских култура инфицираних овим рекомбинантним RV показале су да је ћелијска смрт значајно повећана паралелно са прекомерном експресијом RV G и да је апоптоза главни механизам укључен у смрт посредовану RV G. Конкретно, смањење бојења F-актина након инфекције SPBNGA-GA је у складу са деполимеризацијом актинских филамената изазваном апоптозом. Штавише, број TUNEL-позитивних језгара у неуронима инфицираним SPBNGA-GA је значајно повећан у поређењу са оним у неинфицираним и SPBNGA-инфицираним неуронима. Међутим, механизам којим ген RV G посредује у процесу апоптотске сигнализације остаје углавном непознат. Сугерисано је да експресија RV G изнад одређеног прага озбиљно ремети ћелијску мембрану. Веома је вероватно да се апоптотске ћелије не уклањају брзо у ЦНС-у и стога подлежу секундарној некрози. [ 58 ] С друге стране, RV инфекција, а посебно прекомерна експресија RV G протеина, може довести до пироптозе, пута ћелијске смрти сличног апоптози који, за разлику од апоптозе, укључује активацију каспазе 1 и тиме доводи до некрозе. [ 59 ] Степен некрозе или пироптозе изазване RV инфекцијом вероватно игра кључну улогу у индукцији антивирусног имунитета. Док апоптотске ћелије одржавају интегритет своје мембране и не стимулишу урођени имуни одговор, некротичне ћелије постају пермеабилизоване и луче ендогене адјувансе који могу покренути снажан урођени имуни одговор. [ 60 ]
Пошто ниво апоптозе/некрозе корелира са имуногеношћу ротавируса, сугерисано је да имуностимулаторни ефекат апоптотских/некротичних ћелија највероватније доприноси стварању заштитног имуног одговора. Стога је регулација експресије G вируса ротавируса веома вероватно важан фактор у патогенези беснила, јер омогућава преживљавање и ширење патогених варијанти ротавируса у нервном систему без изазивања очигледног оштећења неурона и изазивања заштитног имуног одговора који би спречио инфекцију.
Експресија RV G може бити регулисана на нивоу синтезе РНК, посттранслационом нивоу или на оба. Показало се да се нивои RV G које експресују различите RV химерне варијанте одражавају брзином синтезе вирусне РНК, што сугерише да диференцијална регулација експресије RV G од стране ових варијанти произилази из варијација у брзини транскрипције вирусне мРНК. Као и код брзина транскрипције вирусне РНК, количина RV G коју експресују ове варијанте обрнуто корелира са вирусном патогеношћу. С друге стране, инфекција примарних неуронских култура са мање патогеном RV варијантом CVS-B2c резултирала је четвороструко вишим нивоима G протеина него инфекција са високо патогеном варијантом CVS-N2c, упркос синтези упоредивих нивоа G мРНК у обе инфекције. Експерименти са пулс-чејзом показали су да су виши нивои G протеина у неуронима инфицираним CVS-B2c углавном резултат ниже брзине разградње CVS-B2c G протеина у поређењу са CVS-N2c G протеином. Међутим, механизам који доводи до брже протеолитичке разградње CVS-N2c G протеина остаје да се разјасни.
Симптоми беснило
Период инкубације за беснило је у просеку 30-90 дана. У случају масивне инфекције кроз велике ране на глави и лицу, може се скратити на 12 дана. У ретким случајевима, период инкубације може трајати 1 годину или дуже.
Постоји строго секвенцијална смена три периода болести: продромалног, ексцитације, парализе.
Продромални период почиње појавом бола или вучења на месту уједа, као и бола дуж живаца. У пределу ожиљка може се јавити осећај печења, свраб, понекад црвенило и оток. Пацијент осећа општу слабост, главобољу, мучнину. Примећује се повраћање, повећање телесне температуре на 37,5-38°C и симптоми прогресивног менталног поремећаја: повећана рефлексна ексцитабилност, необјашњив осећај анксиозности, страха, меланхолије. Често је пацијент депресиван, инхибиран, повучен у себе, одбија да једе, лоше спава, жали се на мрачне мисли, застрашујуће снове. Продромални период траје 2-3 дана, понекад се продужава до 7 дана. На крају овог периода могу се јавити напади анксиозности са краткотрајним отежаним дисањем, осећајем стезања у грудима, праћеним тахикардијом и убрзаним дисањем.
Период узбуђења обележава се појавом хидрофобије: при покушају пијења, а затим и при погледу на воду или подсећању на њу, пацијент доживљава конвулзивни грч ждрела и гркљана, током којег уз врисак баца шољу воде, баца напред дрхтаве руке, забацује главу и тело уназад. Врат је истегнут, болна гримаса искривљује лице, које постаје плавкасто због грчева респираторних мишића. Очи буље, изражавају страх, моле за помоћ, зенице су проширене, удисање је отежано. У врхунцу напада могућ је срчани и респираторни застој. Напад траје неколико секунди, након чега се стање пацијента чини да се побољшава. Након тога, напади грчева мишића гркљана и ждрела могу се јавити чак и од кретања ваздуха (аерофобија), јаке светлости (фотофобија) или гласне речи (акустикофобија). Напади су праћени психомоторном агитацијом, током које се пацијент понаша као „лудак“. Свест је замућена током напада, али се разбистри у интерикталном периоду. Током периода узнемирености, због повећаног тонуса симпатичког нервног система, пацијенти доживљавају нагло повећање саливације (сијалореја) са немогућношћу гутања пљувачке услед спазма фарингеалних мишића. Пацијент прска пљувачку. Код неких пацијената могу се развити знаци менингизма, па чак и опистотонуса, а честе су и конвулзије. У овом случају, цереброспинална течност се можда неће променити, али код неких пацијената може доћи до повећања концентрације протеина и повећања броја ћелија због лимфоцита.
Без адекватног лечења, знаци дехидрације се повећавају, црте лица постају оштрије, а телесна тежина се смањује. Телесна температура расте до високих вредности. Могуће су конвулзије. Трајање фазе ексцитације је око 2-3 дана, ретко 4-5 дана. Смртни исход се обично јавља током једног од напада. Ретко пацијент преживи до треће фазе болести.
Током периода парализе, пацијент се смирује. Напади хидрофобије престају, пацијент може да пије и гута храну, свест је јасна. Међутим, упркос привидном благостању, летаргија, апатија, депресија се појачавају, парализа удова, карлични поремећаји, убрзо се јављају парализа кранијалних нерава. Телесна температура расте на 42-43 °C, артеријски притисак пада, а до краја првог дана наступа смрт од парализе кардиоваскуларног и респираторног центра.
У периферној крви се примећују неутрофилна леукоцитоза, повећање хемоглобина, еритроцита и хематокрита.
Шта те мучи?
Обрасци
Клинички се разликују типични и атипични облици. Атипични облици обухватају све случајеве без узбуђења и хидрофобије. Атипични облици укључују булбарни, церебеларни, менингоенцефалитични итд.
Дијагностика беснило
Детекција антигена беснила, антитела, вирусне РНК или изолација вируса омогућава дијагнозу беснила. Пошто сваки појединачни тест може бити негативан код пацијента са беснилом, понекад су неопходни серијски узорци серума за детекцију антитела против беснила, узорци пљувачке за вирусну културу и биопсија коже за директно имунофлуоресцентно тестирање на вирусни антиген, посебно када постоји велика сумња на беснило.
Једна од најбржих метода за дијагностиковање антеморталног беснила код људи јесте извођење директног имунофлуоресцентног теста на биопсији коже са потиљка ради откривања антигена беснила. Директни имунофлуоресцентни тест је најосетљивија и најспецифичнија метода за откривање антигена беснила у кожи и другим свежим ткивима (нпр. биопсија мозга), иако резултати повремено могу бити негативни у раној фази болести. Ако свеже ткиво није доступно, ензимска дигестија фиксираних ткива може повећати реактивност имунофлуоресцентног теста; међутим, осетљивост може бити неприхватљиво ниска.
Дијагноза се такође може поставити ако се вирус изолује из пљувачке након инокулације ћелија неуробластома или лабораторијских глодара; ово је обично најефикасније током прве 2-3 недеље болести. Детекција антитела која неутралишу вирус беснила, обично се врши брзим тестом инхибиције флуоресцентног фокуса (RFFIT), у серуму невакцинисаних особа је такође дијагностичка. Присуство антитела у цереброспиналној течности потврђује дијагнозу, али се могу појавити 2-3 дана касније од серумских антитела и стога могу бити мање корисна у раним фазама болести. Док се серолошки одговор након вакцинације генерално не разликује од серолошког одговора изазваног болешћу, вакцинација обично не производи антитела на цереброспиналну течност.
Само седам случајева „опоравка“ од беснила у последњих 25 година је добро документовано. Иако вирус беснила није изолован ни код једног пацијента, високи титри антитела која неутралишу беснило у узорцима серума и присуство неутралишућих антитела у цереброспиналној течности снажно су поткрепили дијагнозу.
Шта треба испитати?
Који су тестови потребни?
Диференцијална дијагноза
Дијагноза људског беснила се обично поставља на основу епидемиолошких и клиничких података и потврђује се у лабораторији. Дијагноза је једноставна ако постоји историја уједа животиња и ако се јавио цео спектар симптома и знакова. У супротном, неопходна је пажљива, али брза процена епидемиолошких и клиничких карактеристика мање типичних случајева пре извођења специфичних лабораторијских тестова. Сваког пацијента са неуролошким знацима или симптомима или необјашњивим енцефалитисом треба питати о могућности изложености животињама у подручјима ендемским за беснило унутар или ван земље пребивалишта. Непосумња на беснило у неколико недавних смртних случајева људи у Сједињеним Државама могла је бити последица недостатка пажљиве историје изложености.
На почетку болести, беснило може да имитира многе заразне и незаразне болести. Многи други енцефалити, попут оних изазваних херпесвирусима и арбовирусима, подсећају на беснило. Друге заразне болести такође могу да имитирају беснило, попут тетануса, церебралне маларије, рикециозе и тифуса. Паралитичке заразне болести које се могу помешати са беснилом укључују полиомијелитис, ботулизам и херпес симијан Б енцефалитис.
Неинфективне болести које се могу помешати са беснилом укључују бројне неуролошке синдроме, посебно акутну инфламаторну полинеуропатију (Гијен-Бареов синдром), као и алергијски поствакцинални енцефаломијелитис секундарно настао након вакцинације против беснила нервног ткива, тровања или интоксикације дрогама, апстиненцијалне кризе од алкохола, акутну порфирију и хистерију изазвану беснилом. Гијен-Бареов синдром се може помешати са паралитичким беснилом и обрнуто.
Кога треба контактирати?
Третман беснило
Лечење беснила није развијено. Примена великих доза специфичног антирабичног имуноглобулина и леукоцитарног интерферона је неефикасна. Симптоматско лечење се спроводи ради ублажавања патње пацијента. У ту сврху, пацијент се смешта у посебно одељење или бокс, ствара се заштитни режим који ограничава утицај спољашње средине (смањена бука, јако светло, проток ваздуха). Да би се смањила ексцитабилност централног нервног система, прописују се таблете за спавање, антиконвулзиви и лекови против болова. Водени биланс се нормализује.
У паралитичкој фази се прописују лекови који стимулишу активност кардиоваскуларног и респираторног система. Препоручује се употреба хипербаричне оксигенације, церебралне хипотермије, контролисаног механичког дисања уз потпуну кураризацију пацијента. Међутим, све методе лечења су практично неефикасне. У најбољем случају, могуће је продужити живот пацијента за неколико месеци. Неповољан исход је предодређен тежином оштећења можданог стабла са уништавањем виталних центара.
Превенција
Развој прве вакцине против беснила од стране Пастера 1885. године увео је у еру много ефикасније контроле беснила. Данас, упркос скоро 100% стопи смртности код људи од беснила, болест се може потпуно спречити вакцинацијом пре и/или након излагања. Док су Пастер и његове колеге покренули вакцинацију приватних паса у Паризу, прва масовна вакцинација паса спроведена је почетком 1920-их у Јапану, што је означило први велики национални програм контроле беснила. Орална вакцинација дивљих животиња, први пут развијена 1970-их, од тада је више пута показала да ефикасно контролише болест код главних копнених домаћина као што су лисице, ракуни и творови.[ 68 ] Континуирана вакцинација против беснила популација резервоарских животиња са стопом покривености од 70% или више ће на крају елиминисати RABV из резервоарских врста и спречити ширење вируса на случајне домаћине.[ 69 ]
Филогенетски подаци указују на то да су лисавируси инфицирали слепе мишеве много пре него што су инфицирали копнене сисаре, а већина лисавируса, укључујући RABV, и даље циркулише код различитих врста слепих мишева широм света.[ 70 ] Међутим, ефикасне методе за спречавање преноса RABV међу слепим мишевима остају недостижне, што искључује могућност потпуног искорењивања беснила у овом тренутку. Међутим, чак и након излагања RABV-у путем уједа сисара зараженог беснилом, безбедна и ефикасна постекспозициона профилакса (PEP, укључујући чишћење рана, имуноглобулин против беснила и вакцинацију против беснила) може заштитити људе од инфекције беснилом ако се лечење спроведе брзо и у складу са препорукама Светске здравствене организације (СЗО).
Ове две методе спречавања људских смрти – једна заснована на вакцинацији изложених људи и друга заснована на вакцинацији довољног броја паса да би се прекинуо циклус преношења на извору – представљају темеље приступа „једно здравље“ превенцији и контроли беснила код паса. Ова два различита начина спречавања људских смрти разматрана су као одвојене алтернативе: Стратегија А, заснована на пружању ПЕП-а људима, и Стратегија Б, заснована на вакцинацији паса; или као компоненте комбиноване Стратегије А + Б у анализи вероватних трошкова алтернативних стратегија.[ 71 ]
Земље попут Тајланда постигле су огроман успех у спречавању људских смртних случајева употребом ПЕП-а, али су такође откриле све већу потражњу и повезане трошкове повезане са само употребом ПЕП-а. [ 72 ] На пример, у поређењу са ситуацијом из 1991. године, четири пута више људи (више од 400.000) је имало потребу за ПЕП-ом 2003. године. Недавни подаци показују да Народна Република Кина, која вакцинише 15 милиона људи годишње након потенцијалне изложености беснилу, троши око 650 милиона америчких долара годишње само на ПЕП. [ 73 ]
Много одрживији приступ је спречавање ширења инфекције на извору, у популацији животиња, уз истовремено повећање приступа ПЕП-у за изложене људске пацијенте када је то потребно. Тамо где постоји политичка воља и адекватно финансирање за контролу беснила код паса, смртни случајеви могу и јесу елиминисани. Широко распрострањена употреба вакцинације паса довела је до елиминације беснила код паса у неколико земаља, укључујући Малезију 1954. године, [ 74 ] Јапан 1956. године, Тајван 1961. године, Сингапур и, посебно, широм Западне Европе (прегледано у Rupprecht et al., King et al., и Gongal и Wright). [ 75 ]


 [
[