
Сви иЛиве садржаји су медицински прегледани или проверени како би се осигурала што већа тачност.
Имамо стриктне смјернице за набавку и само линкамо на угледне медијске странице, академске истраживачке институције и, кад год је то могуће, медицински прегледане студије. Имајте на уму да су бројеви у заградама ([1], [2], итд.) Везе које се могу кликнути на ове студије.
Ако сматрате да је било који од наших садржаја нетачан, застарио или на неки други начин упитан, одаберите га и притисните Цтрл + Ентер.
Студија наглашава потребу за терапијама специфичним за тип ћелија за ХИВ
Последње прегледано: 02.07.2025
Истраживачи са Универзитета у Илиноису показали су важност циљања одређених типова ћелија у лечењу ХИВ-а. Њихова студија, објављена у часопису Proceedings of the National Academy of Sciences, једна је од првих која се бави диференцијалним или специфичним за тип ћелија ефектима модулације латенције ХИВ-а на мијелоидне ћелије, врсту имуних ћелија које се производе у коштаној сржи.
Једна од главних препрека у елиминисању ХИВ инфекције је управљање латентношћу, односно периодом током којег заражена ћелија мирује и не може да производи вирус. Латентне ХИВ ћелије се акумулирају у телу на местима познатим као резервоари. Латентни резервоари су проблематични јер могу почети да производе вирус у било ком тренутку.
Потпуно искорењивање болести захтевало би уклањање свих латентних ћелија из тела или трајну отпорност на стимулусе активације. Међутим, реактивацију могу покренути различити фактори, укључујући сигнале који усмеравају диференцијацију мијелоидних ћелија.
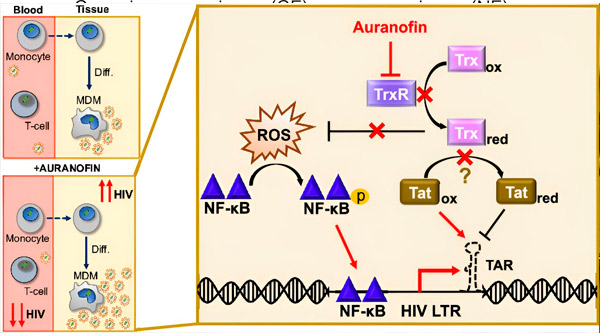
Регулација латенције ХИВ-а у макрофагима изведеним из моноцита (МДМ) може представљати ризик за ширење вируса. Диференцијација моноцита у макрофаге може покренути реактивацију ХИВ-а, потенцијално подстичући ширење вируса у ткивима (горе лево). Клинички кандидат, Ауранофин, смањује вирусну ДНК у крви и подстиче латенцију ХИВ-а у Т ћелијама и моноцитима, али изазива реактивацију ХИВ-а у МДМ (доле лево). Код МДМ, претпостављамо да инхибиција TrxR помоћу Ауранофина доводи до акумулације реактивних врста кисеоника (ROS), што индукује активацију NF-κB и активацију промотера ХИВ LTR (десно). Инхибиција TrxR потенцијално смањује редукцију супстрата, омогућавајући Tat протеину да остане преференцијално оксидован, где се може везати за TAR и покренути транскрипцију ХИВ-а. Извор: Зборник радова Националне академије наука (2024). DOI: 10.1073/pnas.2313823121
Годинама се истраживање лека за ХИВ фокусирало на два приступа позната као „шокирај и убиј“ и „блокирај и закључај“. Први делује у комбинацији са антиретровирусном терапијом како би активирао латентно инфициране ћелије и убио их путем апоптозе, односно програмиране ћелијске смрти, док други приморава инфициране ћелије у дубоко латентно стање из којег се не могу саме реактивирати.
Истраживања ових техника традиционално су се фокусирала на врсту белих крвних зрнаца названих Т ћелије, које су примарна мета ХИВ инфекције. Међутим, латентни резервоари се састоје од више од само Т ћелија; у ствари, они садрже десетине различитих типова ћелија, сваки са својим јединственим обрасцима експресије ХИВ гена.
„Постоји огромна разноликост ћелија, чак и унутар једне лозе“, рекао је Колин Кифер, ванредни професор микробиологије и аутор рада. „Варијабилност одговора у овим резервоарима повећава се са сваким новим типом ћелије.“
Александра Бланко, постдипломац у Киферовој лабораторији, желела је да проучава типове ћелија који су били пропуштени у традиционалним истраживањима ХИВ-а. Фокусирајући се на мијелоидне ћелије, креирала је библиотеку клонова која садржи 70 популација латентно инфицираних моноцита. Бланко је затим анализирала клонске популације и њихове одговоре на активацију. Одговори су се значајно разликовали, истичући велику разноликост унутар једног типа ћелија.
Ово запажање покренуло је ново питање: да ли различити типови ћелија заиста имају различите одговоре на третмане латентности ХИВ-а? Заиста, њихови налази су показали да неке терапије латентности ХИВ-а могу промовисати латентност у Т ћелијама и моноцитима, док могу преокренути латентност у макрофагима.
„Нису све ћелије у телу исте“, рекао је Кифер. „Дакле, има смисла да неће све заражене ћелије реаговати на вирус на исти начин.“
Њихов рад истиче потребу да будући третмани ХИВ-а узму у обзир све типове ћелија и како свака ћелија може реаговати на потенцијалне терапије.
Њихови налази се надовезују на истраживање Роја Дара, бившег професора биоинжењеринга из Илиноиса, чија је лабораторија проучавала хетерогеност у експресији гена ХИВ-а.
„Он је то започео, а ми смо то преузели и изградили до места где је данас“, рекао је Кифер. „Дакле, сарадња је заиста покренула ове резултате. Претворила се у нови правац за нашу лабораторију и заиста смо узбуђени због тога.“
Додатни и неочекивани налаз из Бланкове анализе открио је промене у величини и облику ћелија као одговор на инфекцију, што сугерише да ХИВ може да промени морфологију ћелија. Бланков следећи циљ је да идентификује биолошке механизме који леже у основи ових фенотипских промена.
Кифер и чланови његове лабораторије такође се радују репродукцији својих резултата, који су углавном урађени на ћелијској линији, у примарним ћелијама. Репродукција резултата у моделу сличнијем људском побољшала би клинички значај студије, објаснио је Кифер.
„Желели бисмо да урадимо већа испитивања Т ћелија, моноцита и макрофага како бисмо идентификовали потенцијалне лекове који би могли да делују на све ове типове ћелија“, рекао је Бланко. „Можда ћемо пронаћи још више молекула који се не понашају на начин специфичан за тип ћелија.“
