
Сви иЛиве садржаји су медицински прегледани или проверени како би се осигурала што већа тачност.
Имамо стриктне смјернице за набавку и само линкамо на угледне медијске странице, академске истраживачке институције и, кад год је то могуће, медицински прегледане студије. Имајте на уму да су бројеви у заградама ([1], [2], итд.) Везе које се могу кликнути на ове студије.
Ако сматрате да је било који од наших садржаја нетачан, застарио или на неки други начин упитан, одаберите га и притисните Цтрл + Ентер.
Уобичајена нежељена трудноћа - узроци
Медицински стручњак за чланак
Последње прегледано: 04.07.2025
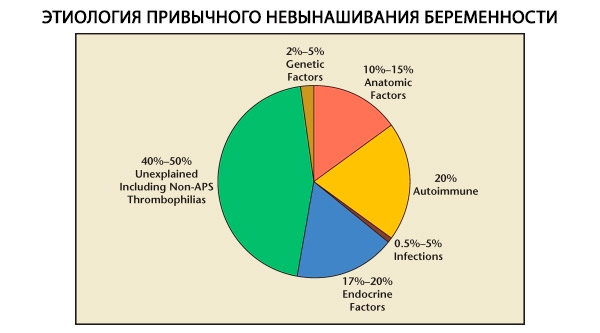
У структури уобичајених побачаја разликују се генетски, анатомски, ендокрини, имунолошки и инфективни фактори. Када се искључе сви наведени узроци, остаје група пацијенткиња код којих је порекло уобичајеног побачаја нејасно (идиопатски побачаји). Према Ц. Куламу и др. (1996), 80% идиопатских побачаја заснива се на непрепознатим имунолошким поремећајима.
Не постоје убедљиви докази да ендометриоза узрокује поновљене побачаје, или да медицински или хируршки третман ендометриозе смањује учесталост поновљених побачаја.
Према актуелним схватањима, поред генетских и делимично инфективних узрока који доводе до формирања абнормалног ембриона, спровођење штетног дејства других фактора (анатомских, ендокриних, имунолошких) састоји се у стварању неповољне позадине за развој генетски комплетне оплођене јајне ћелије, што доводи до исцрпљивања резервног капацитета хориона и престанка развоја (ембриогенезе). Критични периоди у првом тромесечју трудноће препознају се као 6-8 недеља (смрт ембриона) и 10-12 недеља (избацивање оплођене јајне ћелије).
 [ 1 ]
[ 1 ]
Генетски узроци уобичајеног побачаја
Генетски фактори чине 3–6% узрока уобичајених побачаја. Код спорадичних прекида трудноће у првом тромесечју, око 50% побачаја има хромозомске абнормалности. Већина њих (95%) су промене у броју хромозома - монозомија (губитак једног хромозома), тризомија (присуство додатног хромозома), које су резултат грешака у мејози, као и полиплоидија (повећање састава хромозома за потпуни хаплоидни сет), која настаје када јајну ћелију оплоде два или више сперматозоида. Код спорадичних побачаја, тризомија се најчешће среће - 60% свих мутација (најчешће на хромозому 16, као и 13, 18, 21, 22), на другом месту по учесталости је Шерешевски-Тарнеров синдром (хромозом 45 X0) - 20%, преосталих 15% чини полиплоидија (посебно триплоидија).
У случају промене броја хромозома код абортуса, испитивање кариотипа родитеља најчешће не открива никакву патологију и вероватноћа хромозомске болести фетуса током накнадне трудноће је 1%. Насупрот томе, приликом испитивања абортуса код парова са уобичајеним побачајем, структурне промене хромозома (интра- и интерхромозомске) се примећују у 3-6% случајева. Приликом испитивања кариотипа родитеља, уравнотежени хромозомски преуређења се налазе у 7% случајева. Најчешће се ради о реципрочним транслокацијама, код којих се сегмент једног хромозома налази на месту другог сегмента нехомологног хромозома, као и о мозаицизму полних хромозома, инверзији и детекцији хромозома у облику прстена. У случају присуства таквих преуређења код једног од супружника, процеси упаривања и раздвајања хромозома су отежани током мејозе, што резултира губитком (делецијом) или удвостручавањем (дупликацијом) делова хромозома у гаметима. Ово резултира такозваним неуравнотеженим хромозомским преуређењима, код којих је ембрион или неодржив или служи као носилац тешке хромозомске патологије. Вероватноћа да ће се дете родити са неуравнотеженим хромозомским абнормалностима у присуству уравнотежених хромозомских преуређења у кариотипу једног од родитеља је 1–15%. Разлике у подацима повезане су са природом преуређења, величином укључених сегмената, полом носиоца и породичном историјом.
Дијагностика
Анамнеза
- Наследне болести код чланова породице.
- Присуство конгениталних аномалија у породици.
- Рођење деце са менталном ретардацијом.
- Присуство неплодности и/или побачаја непознатог порекла код брачног пара или код рођака.
- Присуство нејасних случајева перинаталног морталитета.
Специјалне методе истраживања
- Студија кариотипа родитеља је посебно индикована за брачне парове при рођењу новорођенчета са развојним дефектима поред историје побачаја, као и у случајевима уобичајеног побачаја у раним фазама трудноће.
- Цитогенетска анализа побачаја у случајевима мртворођености или неонаталне смртности.
Индикације за консултације са другим специјалистима
Ако се код родитеља открију промене у кариотипу, неопходна је консултација са генетичарем како би се проценио степен ризика од рађања детета са патологијом или, ако је потребно, да се одлучи о питању донирања јајне ћелије или сперме.
Даље лечење пацијента
Ако брачни пар има патолошки кариотип, чак и код једног од родитеља, препоручује се спровођење пренаталне дијагностике током трудноће - хорионска биопсија или амниоцентеза - због високог ризика од развојних поремећаја код фетуса.
Анатомски узроци уобичајеног побачаја
Анатомски узроци уобичајеног побачаја укључују:
- конгениталне аномалије у развоју материце (потпуно удвостручавање материце; дворогаста, седласта, једнорогаста материца; делимични или потпуни интраутерини септум);
- стечени анатомски дефекти;
- интраутерине адхезије (Ашерманов синдром);
- субмукозни фиброиди материце;
- истмичко-цервикална инсуфицијенција.
Учесталост анатомских аномалија код пацијенткиња са уобичајеним побачајем креће се од 10 до 16%. Учесталост појаве малформација материце које могу резултирати побачајем (али не и неплодношћу) у односу на све малформације материце је следећа: дворога материца - 37%, седласта материца - 15%, интраутерина септум - 22%, потпуно удвостручење материце - 11%, једнорога материца - 4,4%.
Дијагноза уобичајеног побачаја
Анамнеза
У случају анатомске патологије материце, чешће се примећују касни прекиди трудноће и превремени порођаји, међутим, код имплантације на интраутерином септуму или близу миоматозног чвора, могући су и рани прекиди трудноће.
За истмичко-цервикалну инсуфицијенцију, патогномонични знак је спонтани прекид трудноће у другом тромесечју или рани превремени порођај, који се јавља релативно брзо и са мало бола.
У случају малформација материце, потребно је обратити пажњу на анамнестичке индикације патологије уринарног тракта (често пратеће конгениталне аномалије материце) и природу развоја менструалне функције (индикације хематометре са функционалним рудиментарним рогом материце).
Специјалне методе испитивања
- Тренутно се хистеросалпингографија изводи ради постављања дијагнозе, што омогућава проучавање облика материчне дупље, идентификовање присуства субмукозних фиброма, адхезија, септа и одређивање проходности јајовода. Ради дијагностиковања патологије материце, рационално је извршити хистеросалпингографију у периоду између менструације и овулације, односно у првој фази менструалног циклуса након престанка крвавог исцедка (7-9. дан циклуса). За дијагнозу истмичко-цервикалне инсуфицијенције, студија се изводи у другој фази менструалног циклуса (18-20. дан) како би се утврдило стање унутрашњег отвора грлића материце. Пре извођења хистеросалпингографије, неопходно је искључити инфламаторне болести карличних органа или их лечити.
- Хистероскопија је последњих година постала широко распрострањена и постала је златни стандард за дијагностиковање интраутерине патологије. Међутим, због веће цене у поређењу са хистеросалпингографијом, метода се користи код жена са индикацијом интраутерине патологије на основу прелиминарних ултразвучних података. Хистероскопија се може користити за преглед материчне дупље, утврђивање природе интраутерине патологије и, уколико је доступна потребна опрема (резектоскоп), извођење минимално инвазивног хируршког лечења - уклањање адхезија, субмукозних миомских чворова и ендометријалних полипа. Приликом уклањања интраутерине преграде, предност се даје хистерорезектоскопији са лапароскопском контролом, што спречава могућност перфорације зида материце.
- Ултразвук се изводи у првој фази менструалног циклуса, што омогућава претпостављену дијагнозу субмукозног миома материце, интраутериних адхезија, а у другој фази циклуса - идентификовање интраутерине преграде и двороге материце. Ова метода је од посебног значаја у раним фазама трудноће, када је њена осетљивост у дијагностиковању ових стања 100%, а специфичност 80%. Ван трудноће, дијагноза захтева додатну потврду другим методама.
- Страни аутори истичу предност сонохистерографије (ултразвук помоћу трансвагиналног сензора са претходним увођењем 0,9% раствора натријум хлорида у материчну дупљу) у односу на хистеросалпингографију, јер омогућава диференцијалну дијагностику између интраутерине преграде и дворожђе материце. Сонохистерографијом је могуће не само проучавати облик материчне дупље, већ и одредити конфигурацију дна тела материце. У нашој земљи ова метода није стекла широку распрострањеност.
- У неким сложеним случајевима, МРИ карличних органа се користи за верификацију дијагнозе. Метода омогућава добијање вредних информација у случају развојних аномалија материце праћених атипичним распоредом органа у карлици. МРИ је важна у случају рудиментарног рога материце како би се одлучило да ли је препоручљиво уклонити га. Потреба за уклањањем рудиментарног рога материце јавља се у случају његове повезаности са јајоводом и јајником како би се спречило формирање и развој оплођене јајне ћелије у њему. Прекид трудноће у случају анатомских аномалија материце може бити повезан са неуспешном имплантацијом оплођене јајне ћелије (на интраутерином септуму, близу субмукозног миомског чвора), недовољно развијеном васкуларизацијом и пријемом ендометријума, блиским просторним односима у материчној дупљи (на пример, у случају деформације шупљине миомским чвором), често праћеним ИЦИ, и хормонским поремећајима.
Лечење уобичајеног побачаја
Хируршко лечење
У присуству интраутерине преграде, субмукозних миомских чворова и адхезија, најефикасније хируршко лечење је хистерорезектоскопијом. Учесталост накнадних побачаја код ове групе жена након лечења је 10% у поређењу са 90% пре операције. Приликом упоређивања резултата метропластике изведене лапаротомијом и трансцервикалном хистерорезектоскопијом, П. Хејнонен (1997) је добио резултате који указују на мању трауму и већу ефикасност хистерорезектоскопије; проценат трудноћа које су резултирале рађањем одрживе деце био је 68 и 86%, респективно.
Хируршко уклањање интраутерине преграде, адхезија и субмукозних миомских чворова елиминише побачај у 70–80% случајева. Међутим, неефикасно је код жена са малформацијама материце које су имале нормалне порођаје са накнадним поновљеним побачајима. Вероватно је да у таквим случајевима анатомски фактор није водећи узрок и да је потребно тражити друге узроке побачаја.
Доказано је да је абдоминална метропластика повезана са значајним ризиком од постоперативног неплодности и не побољшава прогнозу накнадне трудноће. Стога је боље дати предност хистероскопији и лапароскопским операцијама.
Лечење лековима
Ефикасност увођења спирале, високих доза естрогених лекова, увођења Фолијевог катетера у материчну дупљу након операција за уклањање адхезија, интраутерине септуме није доказана. Препоручује се планирање трудноће најраније 3 месеца након операције. Да би се побољшао раст ендометријума, циклична хормонска терапија се спроводи током 3 менструална циклуса [14]. Током 3 месеца у првих 14 дана циклуса, препоручљиво је узимати лек који садржи 2 мг 17-бета-естрадиола, у наредних 14 дана - 2 мг 17-бета-естрадиола и 20 мг дидрогестерона (10 мг дидрогестерона као део комбинованог лека плус 10 мг дидрогестерона у посебном облику таблета).
Даље лечење пацијента
Карактеристике тока трудноће са дворогом материцом или удвостручењем материце (када постоје 2 материчне шупљине):
- у раним фазама трудноће, крварење се често јавља из „празног“ рога или материчне шупљине због изражене децидуалне реакције; тактика у овом случају треба да буде конзервативна и да се састоји од употребе антиспазмодичних и хемостатских средстава;
- претња прекида трудноће у различитим фазама;
- развој истмичко-цервикалне инсуфицијенције;
- интраутерино заостајање у расту због плацентне инсуфицијенције.
У раним фазама трудноће, у случају крварења, препоручљиво је мировање у кревету и полумировање у кревету, као и примена хемостатских, антиспазмодичних и седативних лекова, и терапија гестагенима (дидрогестерон у дневној дози од 20 до 40 мг) до 16–18 недеља гестације.
Ендокрини узроци уобичајеног побачаја
Према различитим ауторима, ендокрини узроци побачаја чине 8 до 20%. Најзначајнији од њих су недостатак лутеалне фазе (ЛФФ), хиперсекреција ЛХ, дисфункција штитне жлезде и дијабетес мелитус.
Тешка болест штитне жлезде или дијабетес мелитус могу довести до поновљених побачаја. Међутим, код компензованог дијабетес мелитуса, ризик од уобичајених побачаја се не разликује од ризика у општој популацији.
Истовремено, висока учесталост хипотиреоидизма у популацији захтева скрининг са мерењем нивоа ТСХ. Код пацијенткиња са уобичајеним побачајем, инсуфицијенција лутеалне фазе се примећује у 20–60% случајева, а ултразвучни знаци полицистичних јајника - у 44–56%. Према литератури, утицај појединачних хормонских поремећаја на формирање симптомског комплекса уобичајеног побачаја остаје контроверзан. Студије М. Огасаваре и др. (1997) нису откриле поуздане разлике у учесталости прекида трудноће са и без ЛПИ код пацијенткиња са два или више претходних побачаја у анамнези, искључујући аутоимуне, анатомске и инфективне узроке.
Недостатак функције жутог тела може бити резултат низа неповољних фактора:
- поремећаји у лучењу ФСХ и ЛХ у првој фази менструалног циклуса;
- рани или, обрнуто, прекасни врх ослобађања ЛХ;
- Хипоестрогенизам као последица неадекватне фоликулогенезе. Сва ова стања нису подложна корекцији супституционом терапијом гестагеним лековима у постовулаторном периоду. Проспективне студије које су спровели Л. Реган и др. показале су значајно повећање учесталости побачаја код пацијенткиња са хиперсекрецијом ЛХ 8. дана менструалног циклуса у поређењу са женама са нормалним нивоима ЛХ у крви (65% и 12% побачаја, респективно). Штетни ефекат превременог пораста ЛХ повезан је са превременим наставком друге мејотичке деобе и овулацијом незреле јајне ћелије, као и са индукцијом производње андрогена од стране тека ћелија заједно са оштећеним пријемом ендометријума под утицајем гестагене инсуфицијенције. Међутим, претходно смањење преовулаторних нивоа ЛХ агонистима гонадотропин-ослобађајућег хормона без додатних мера усмерених на продужење накнадне трудноће не обезбеђује очекивано смањење учесталости побачаја.
Златни стандард за дијагностиковање НЛФ је хистолошки преглед материјала добијеног биопсијом ендометријума у другој фази циклуса током 2 менструална циклуса.
Дијагноза других узрока овулаторне дисфункције, као што су хиперпролактинемија, хипотиреоза, функционални вишак андрогена (јајника или надбубрежне жлезде), мора бити праћена прописивањем одговарајућег лечења.
Дијагностика
Анамнеза и физички преглед
- Анамнеза. Фактори које треба узети у обзир: касна менарха, нередован менструални циклус (олигоменореја, аменореја, нагло повећање телесне тежине, губитак тежине, неплодност, уобичајени рани побачаји).
- Преглед: тип тела, висина, телесна тежина, хирзутизам, израженост секундарних полних карактеристика, присуство стрија, преглед млечних жлезда на галактореју.
- Функционални дијагностички тестови: мерење ректалне температуре током 3 менструална циклуса.
Специјалне методе истраживања
- Хормонска студија:
- у 1. фази менструалног циклуса (7–8. дан) – одређивање садржаја ФСХ, ЛХ, пролактина, ТСХ, тестостерона, 17-хидроксипрогестерона (17-ОП), ДХЕАС;
- у 2. фази менструалног циклуса (21–22 дана) – одређивање садржаја прогестерона (нормативни индикатори нивоа прогестерона су веома варијабилни, метода се не може користити без узимања у обзир других фактора).
- Ултразвук:
- у првој фази менструалног циклуса (5–7. дан) – дијагноза ендометријалне патологије, полицистичних јајника;
- у другој фази менструалног циклуса (20–21 дан) – мерење дебљине ендометријума (нормално 10–11 мм, корелира са садржајем прогестерона).
- Биопсија ендометријума ради верификације НЛФ-а се врши 2 дана пре очекиване менструације (26. дана са циклусом од 28 дана). Ова метода се користи у случајевима када је дијагноза нејасна. Да би се проучиле промене у ендометријуму у такозваном периоду „имплантационог прозора“, биопсија се врши 6. дана након овулације.
Лечење
Приликом дијагностиковања НЛФ (према ректалним температурним графиконима, трајање 2. фазе је мање од 11 дана, примећује се постепено повећање температуре, недовољна секреторна трансформација ендометријума према подацима биопсије ендометријума, низак ниво прогестерона у крвном серуму), неопходно је идентификовати узрок таквих поремећаја.
Ако је НЛФ праћен хиперпролактинемијом, изводи се МРИ мозга. Алтернативна метода је рендгенски снимак лобање (регија турског седла).
Прва фаза код хиперпролактинемије је искључивање аденома хипофизе, што захтева хируршко лечење. У одсуству значајних промена, хиперпролактинемија се сматра функционалном, а лечење бромокриптином се прописује ради нормализације нивоа пролактина. Почетна доза бромокриптина је 1,25 мг/дан током 2 недеље, након праћења нивоа пролактина, ако се индикатори не нормализују, доза се повећава на 2,5 мг/дан. Са значајним повећањем нивоа пролактина, почетна доза је 2,5 мг/дан. Уколико дође до трудноће, бромокриптин треба прекинути.
Уколико се открије хипотиреоза, природа патологије штитне жлезде се утврђује заједно са ендокринологом. У сваком случају, индикована је дневна терапија натријум левотироксином, доза се бира појединачно док се ниво ТСХ не нормализује. Уколико дође до трудноће, лечење натријум левотироксином треба наставити. Питање о препоручљивости повећања дозе у првом тромесечју трудноће одлучује се заједно са ендокринологом након добијања резултата хормонског прегледа (ниво ТСХ, слободни тироксин).
Корекција НЛФ-а се спроводи на један од два начина. Први начин је стимулација овулације, други начин је супституционална терапија препаратима прогестерона.
Прва опција лечења је стимулација овулације кломифен цитратом. Ова метода лечења се заснива на чињеници да се већина поремећаја лутеалне фазе одвија у фоликуларној фази циклуса. Константно смањени нивои прогестерона у 2. фази су последица поремећене фоликулогенезе у 1. фази циклуса. Овај поремећај ће се са већим успехом кориговати ниским дозама кломифен цитрата у раној фоликуларној фази него прописивањем прогестерона у 2. фази циклуса.
У 1. циклусу, доза кломифен цитрата је 50 мг/дан од 5. до 9. дана менструалног циклуса. Ефикасност се прати помоћу ректалних температурних графикона, мерења нивоа прогестерона у 2. фази циклуса или динамичког ултразвука. Ако нема довољног ефекта у 2. циклусу стимулације овулације, дозу кломифен цитрата треба повећати на 100 мг/дан од 5. до 9. дана циклуса. Максимална могућа доза у 3. циклусу стимулације овулације је 150 мг/дан. Такво повећање дозе је могуће само ако се лек добро подноси (нема интензивних болова у доњем делу стомака и доњем делу леђа и нема других знакова хиперстимулације јајника).
Друга опција лечења: супституциона терапија препаратима прогестерона, који подстичу потпуну секреторну трансформацију ендометријума, што даје неопходан ефекат код пацијенткиња са уобичајеним побачајем са очуваном овулацијом. Поред тога, последњих година је утврђено да примена препарата прогестерона има не само хормонски, већ и имуномодулаторни ефекат, сузбијајући реакције одбацивања имунокомпетентних ћелија у ендометријуму. Конкретно, сличан ефекат је описан за дихидрогестерон у дози од 20 мг/дан. У сврху супституционе терапије, дидрогестерон се користи у дози од 20 мг/дан орално или микронизовани прогестерон вагинално у дози од 200 мг/дан. Лечење се спроводи другог дана након овулације (дан након повећања ректалне температуре) и наставља се 10 дана. Уколико дође до трудноће, лечење препаратима прогестерона треба наставити.
Савремена истраживања нису потврдила ефикасност хуманог хорионског гонадотропина у лечењу понављајућих побачаја.
Код хиперандрогенизма (оваријалне или адреналне генезе) код пацијенткиња са уобичајеним побачајем, индиковано је лечење лековима због утицаја андрогена на потпуност овулације и стање ендометријума. У случају кршења биосинтезе адреналних андрогена, могућ је њихов вирилизујући ефекат на женски фетус, стога се стероидна терапија спроводи у интересу фетуса.
Хиперандрогенизам оваријалног порекла (полицистични јајници)
Анамнеза, физички преглед и резултати специјалистичких прегледа
- Анамнеза: касна менарха, поремећаји менструалног циклуса као што је олигоменореја (обично примарна, ређе секундарна). Трудноће су ретке, обично спонтано прекинуте у првом тромесечју, са дугим периодима неплодности између трудноћа.
- Преглед: хирзутизам, акне, стрије, висок индекс телесне масе (опционо).
- Графикони ректалне температуре: ановулаторни циклуси се смењују са циклусима са овулацијом и НЛФ-ом.
- Хормонски преглед: висок ниво тестостерона, нивои ФСХ и ЛХ могу бити повишени, однос ЛХ/ФСХ је већи од 3. Ултразвук: полицистични јајници.
Лечење
Лечење без лекова
Губитак тежине - дијетална терапија, физичка активност.
Лечење лековима
- Орлистат у дози од 120 мг са сваким главним оброком. Трајање курса се одређује узимајући у обзир ефекат и подношљивост.
- Прелиминарно смањење тестостерона препаратима који садрже ципротерон ацетат (2 мг) и ЕЕ (35 мцг) током 3 менструална циклуса.
- Прекид контрацепције, хормонска подршка друге фазе циклуса (терапија гестагенима) - дидрогестерон у дози од 20 мг/дан од 16. до 25. дана менструалног циклуса. Ако нема спонтане овулације, прећи на следећу фазу.
- Стимулација овулације кломифен цитратом у почетној дози од 50 мг/дан од 5. до 9. дана менструалног циклуса уз истовремену терапију гестагенима (дидрогестерон у дози од 20 мг/дан од 16. до 25. дана циклуса) и дексаметазоном (0,5 мг).
- У одсуству трудноће, доза кломифен цитрата се повећава на 100–150 мг/дан уз примену гестагена у другој фази циклуса и дексаметазона (0,5 мг). Утврђено је да, иако дексаметазон само смањује ниво надбубрежних андрогена, овулација и зачеће се значајно чешће јављају уз лечење кломифен цитратом и дексаметазоном него уз употребу само кломифен цитрата [12].
- Спроводе се три циклуса стимулације овулације, након чега се препоручује пауза од три менструална циклуса уз гестагену подршку и одлука о хируршком лечењу лапароскопским приступом (клинаста ресекција јајника, ласерска вапоризација).
Даље лечење пацијента
Вођење трудноће треба да буде праћено гестагеном подршком до 16 недеља трудноће (дидрогестерон у дози од 20 мг/дан или микронизовани прогестерон у дози од 200 мг/дан), дексаметазон се прописује само у првом тромесечју трудноће. Праћење је обавезно ради благовремене дијагнозе истмичко-цервикалне инсуфицијенције и, ако је потребно, њене хируршке корекције.
Адренални хиперандрогенизам (пубертални и постпубертални адреногенитални синдром)
Адреногенитални синдром (АГС) је наследна болест повезана са поремећајем синтезе хормона надбубрежне коре услед оштећења гена одговорних за синтезу низа ензимских система. Болест се наслеђује аутозомно рецесивно са преносом мутантних гена од оба родитеља, који су здрави носиоци.
У 90% случајева, адреногенитални синдром је узрокован мутацијама у гену CYP21B, што доводи до поремећаја синтезе 21-хидроксилазе.
Анамнеза, физички преглед и резултати специјалистичких прегледа
- Анамнеза: касна менарха, благо продужени менструални циклус, могућа олигоменореја, спонтани побачаји у првом тромесечју, могућа неплодност.
- Преглед: акне, хирзутизам, андроидни тип тела (широка рамена, уска карлица), хипертрофија клиториса.
- Графикони ректалне температуре: ановулаторни циклуси се смењују са циклусима са овулацијом и НЛФ-ом.
- Хормонски тест: високи нивои 17-ОП, ДХЕАС.
- Ултразвук: јајници су непромењени.
Патогномонични знак ван трудноће је повећање концентрације 17-ОП у крвној плазми.
Тренутно се за дијагностиковање латентног, некласичног облика адреналне хиперандрогеније користи тест са АЦТХ. За овај тест се користи Синактен - синтетички полипептид који има својства ендогеног АЦТХ, односно стимулише почетне фазе синтезе стероидних хормона из холестерола у надбубрежним жлездама.
Синактен тест (аналог АЦТХ): 1 мл (0,5 мг) синактена се убризгава поткожно у раме, почетни садржај 17-ОП и кортизола се прво одређује у јутарњем узорку крвне плазме након 9 сати. Контролни узорак крви се узима 9 сати након ињекције да би се одредио ниво 17-ОП и кортизола. Индекс одређивања (D) се затим израчунава помоћу формуле:
Д = 0,052 × 17-ОП + 0,005 × кортизол/17-ОП - 0,018 × кортизол/17-ОП
Ако је коефицијент D мањи или једнак 0,069, то указује на одсуство адреналне хиперандрогеније. Ако је коефицијент D већи од 0,069, треба сматрати да је хиперандрогенизам узрокован дисфункцијом надбубрежних жлезда.
Лечење лековима
Главни ослонац лечења хиперандрогенизма услед недостатка 21-хидроксилазе су глукокортикоиди, који се користе за сузбијање прекомерне секреције андрогена.
Даље лечење пацијента
Због вирилизујућег дејства мајчиних андрогена на фетус, са утврђеном дијагнозом адреналног хиперандрогенизма, лечење дексаметазоном у почетној дози од 0,25 мг се прописује пре трудноће и наставља се у индивидуално одабраној дози (од 0,5 до 1 мг) током целе трудноће. Код жене са уобичајеним побачајем која пати од адреналног хиперандрогенизма, није прикладно прекидати лечење, јер учесталост побачаја у одсуству лечења достиже 14%, а са наставком - 9%.
С обзиром на чињеницу да пацијенткиње са адреногениталним синдромом могу пренети овај ген на фетус, неопходно је спровести пренатални преглед: у 17-18 недељи трудноће прописује се анализа крви како би се одредио садржај 17-ОП код мајке. Ако је ниво хормона у крви повећан, одређује се његова концентрација у амнионској течности. Ако је садржај 17-ОП у амнионској течности повећан, дијагностикује се адреногенитални синдром код фетуса. Нажалост, немогуће је утврдити тежину адреногениталног синдрома (благи или тешки облик са губитком соли) на основу нивоа 17-ОП у амнионској течности. Питање одржавања трудноће у овој ситуацији одлучују родитељи.
Ако је отац детета носилац гена адреногениталног синдрома и било је случајева деце рођене са овим синдромом у породици, онда пацијент, чак и без адреналне хиперандрогеније, прима дексаметазон у интересу фетуса (ради спречавања вирилизације женског фетуса) у дози од 20 мцг/кг телесне тежине, максимално 1,5 мг/дан у 2-3 дозе после оброка. У 17-18 недељи, након одлучивања о полу фетуса и експресији гена адреногениталног синдрома (на основу резултата амниоцентезе), лечење се наставља до краја трудноће ако је фетус девојчица са адреногениталним синдромом. Ако је фетус дечак или девојчица која није носилац гена адреногениталног синдрома, дексаметазон се може прекинути.
Ако жена са уобичајеним побачајем пати од адреналне хиперандрогеније, онда се лечење дексаметазоном спроводи током целе трудноће и прекида се тек након порођаја. Трећег дана након порођаја, доза дексаметазона се постепено смањује (за 0,125 мг свака 3 дана) до потпуног прекида у постпорођајном периоду.
Хиперандрогенизам мешовите генезе (јајничке и надбубрежне)
Анамнеза, физички преглед и резултати специјалистичких прегледа
- Анамнеза: касна менарха, поремећаји менструалног циклуса као што су олигоменореја (обично примарна, ређе секундарна), аменореја, могуће повреде, потреси мозга. Трудноће су ретке, обично спонтано прекинуте у првом тромесечју, дуги периоди неплодности између трудноћа.
- Физички преглед: хирзутизам, акне, стрије, акантоза нигриканс, висок индекс телесне масе, хипертензија.
- Графикони ректалне температуре: ановулаторни циклуси се смењују са циклусима са овулацијом и НЛФ-ом.
- Хормонски преглед: висок ниво тестостерона, нивои ФСХ и ЛХ могу бити повишени, однос ЛХ/ФСХ већи од 3, високи нивои ДХЕАС, 17-ОП, може бити присутна хиперпролактинемија.
- Ултразвук: полицистични јајници.
- Електроенцефалографија: промене у биоелектричној активности мозга.
- Хиперинсулинемија, поремећај метаболизма липида (висок холестерол, липопротеини ниске густине и липопротеини веома ниске густине), смањена толеранција на глукозу или повишен ниво глукозе у крви.
Лечење
Лечење без лекова
Губитак тежине (нискокалорична дијета, физичка активност).
Лечење лековима
Прва фаза - у присуству инсулинске резистенције, препоручује се прописивање метформина у дневној дози од 1000-1500 мг ради повећања осетљивости на инсулин.
Друга фаза - у случају тешких поремећаја менструалног циклуса и високог нивоа тестостерона, препоручује се прописивање лекова са антиандрогеним дејством који садрже ципротерон ацетат (2 мг) и етинил естрадиол (35 мцг) током 3 месеца.
Трећа фаза је стимулација овулације, након чега следи гестагена подршка (шема је описана горе) и узимање дексаметазона у дневној дози од 0,25–0,5 мг.
У случају хиперпролактинемије и хипотиреозе, треба извршити одговарајућу корекцију лекова у циклусима стимулације овулације. Уколико дође до трудноће, бромокриптин треба прекинути, а левотироксин наставити.
Ако је стимулација овулације неефикасна, треба одлучити о питању прописивања директних индуктора овулације, препоручљивости хируршког лечења полицистичних јајника или вантелесне оплодње.
Даље лечење пацијента
Код пацијенткиња са метаболичким синдромом, трудноћа је често компликована артеријском хипертензијом, нефропатијом, хиперкоагулацијом, у вези са чиме је потребно пратити крвни притисак, хемостазиограме од раних фаза трудноће и кориговати настале поремећаје (ако је потребно) антихипертензивним лековима, антитромбоцитним средствима и антикоагулансима. Гестагени лекови се прописују до 16 недеља трудноће - дидрогестерон у дози од 20 мг/дан или микронизовани прогестерон у дози од 200 мг/дан у 2 дозе.
Све жене са хиперандрогенизмом представљају ризичну групу за развој истмичко-цервикалне инсуфицијенције. Праћење стања грлића материце треба спроводити од 16. недеље трудноће, ако је потребно - хируршка корекција истмичко-цервикалне инсуфицијенције.
Имунолошки узроци уобичајеног побачаја
Тренутно је познато да је око 80% свих раније необјашњених случајева поновљеног губитка трудноће (након искључивања генетских, анатомских, хормонских узрока) повезано са имунолошким поремећајима. Разликују се аутоимуни и алоимуни поремећаји, који доводе до уобичајеног побачаја.
Код аутоимуних процеса, сопствена ткива имуног система постају објекат агресије, односно имуни одговор је усмерен против сопствених антигена. У овој ситуацији, фетус секундарно пати као резултат оштећења мајчиних ткива.
Код алоимуних поремећаја, имуни одговор жене је усмерен против ембрионалних/феталних антигена примљених од оца и који су потенцијално страни мајчином телу.
Аутоимуни поремећаји који се најчешће јављају код пацијенткиња са уобичајеним побачајем укључују присуство антифосфолипидних, антитиреоидних и антинуклеарних аутоантитела у серуму. Тако је утврђено да 31% жена са уобичајеним побачајем ван трудноће има аутоантитела на тироглобулин и тироидну пероксидазу (тироидна микрозомална [тироидна пероксидаза] аутоантитела); у овим случајевима, ризик од спонтаног побачаја у првом тромесечју трудноће се повећава на 20%. Код уобичајеног побачаја, присуство антинуклеарних и антитиреоидних антитела указује на потребу за даљим испитивањем како би се идентификовао аутоимуни процес и потврдила дијагноза.
Антифосфолипидни синдром (АПС) остаје општепризнато аутоимуно стање које доводи до смрти ембриона/фетуса.
Алоимуни поремећаји
Тренутно, алоимуни процеси који доводе до одбацивања фетуса укључују присуство повећаног (више од 3) броја заједничких антигена главног комплекса хистокомпатибилности код супружника (често се примећује у крвним браковима); низак ниво блокирајућих фактора у серуму мајке; повећан ниво природних ћелија убица (NK ћелије CD56, CD16) у ендометријуму и периферној крви мајке, како ван трудноће, тако и током трудноће; висок ниво концентрације низа цитокина у ендометријуму и крвном серуму, посебно γ-интерферона, фактора туморске некрозе а, интерлеукина-1 и 2.
Тренутно се проучавају алоимуни фактори који доводе до раних губитака трудноће и начини за исправљање горе наведених стања. Не постоји консензус о методама терапије. Према неким истраживачима, активна имунизација донорским лимфоцитима не производи значајан ефекат, док други аутори описују значајан позитиван ефекат код такве имунизације и лечења имуноглобулинима.
Тренутно, један од имуномодулаторних агенаса у раној трудноћи је прогестерон. Конкретно, студије су доказале улогу дидрогестерона у дневној дози од 20 мг код жена са уобичајеним побачајем у првом тромесечју трудноће са повећаним нивоом CD56 ћелија у ендометријуму.
 [ 11 ], [ 12 ], [ 13 ], [ 14 ], [ 15 ], [ 16 ]
[ 11 ], [ 12 ], [ 13 ], [ 14 ], [ 15 ], [ 16 ]
Генетски одређене тромбофилије
Следећи облици генетски одређених тромбофилија сматрају се тромбофилним стањима током трудноће која доводе до уобичајеног побачаја.
- Недостатак антитромбина III.
- Мутација фактора V (Лајденска мутација).
- Недостатак протеина Ц.
- Недостатак протеина С.
- Мутација гена протромбина G20210A.
- Хиперхомоцистеинемија.
Преглед за идентификацију ретких узрока тромбофилије је неопходан у случајевима када су постојали:
- породична историја - тромбоемболија пре 40. године код рођака;
- поуздане епизоде венске и/или артеријске тромбозе пре 40. године живота;
- рекурентна тромбоза код пацијента и непосредних рођака;
- тромбоемболијске компликације током трудноће и након порођаја при употреби хормонске контрацепције;
- поновљени губици трудноће, мртворођеност, интраутерино заостајање у расту, абрупција плаценте;
- прееклампсија са раним почетком, HELLP синдром.
Инфективни узроци уобичајеног побачаја
Улога инфективног фактора као узрока уобичајеног побачаја тренутно је предмет широке дебате. Познато је да примарна инфекција у раним фазама трудноће може изазвати оштећење ембриона које је неспојиво са животом, што доводи до спорадичног спонтаног побачаја. Међутим, вероватноћа реактивације инфекције истовремено са исходом поновљених губитака трудноће је занемарљива. Поред тога, микроорганизми који изазивају уобичајени побачај тренутно нису пронађени. Студије последњих година показале су да већина жена са уобичајеним побачајем и хроничним ендометритисом има преваленцију 2-3 или више врста облигатних анаеробних микроорганизама и вируса у ендометријуму.
Према В. М. Сиделниковој и др., код жена које пате од уобичајеног побачаја, дијагноза хроничног ендометритиса ван трудноће је хистолошки верификована у 73,1% случајева, а у 86,7% случајева је примећена перзистенција опортунистичких микроорганизама у ендометријуму, што свакако може бити узрок активације имунопатолошких процеса. Мешовита перзистентна вирусна инфекција (вирус херпес симплекса, Коксаки А, Коксаки Б, ентеровируси 68–71, цитомегаловирус) се код пацијенткиња са уобичајеним побачајем налази знатно чешће него код жена са нормалном акушерском анамнезом. К. Кохут и др. (1997) су показали да је проценат инфламаторних промена у ендометријуму и децидуалном ткиву код пацијенткиња са примарним рецидивним побачајем знатно већи него код жена након побачаја са анамнезом најмање једног порођаја у термину.
Бактеријска и вирусна колонизација ендометријума обично је резултат немогућности имуног система и неспецифичних заштитних снага организма (систем комплемента, фагоцитоза) да потпуно елиминишу инфективног агенса, а истовремено је његово ширење ограничено активацијом Т-лимфоцита (Т-помоћника, природних убица) и макрофага. У свим наведеним случајевима долази до перзистенције микроорганизама, коју карактерише привлачење мононуклеарних фагоцита, природних убица, Т-помоћника, који синтетишу различите цитокине, на место хроничне упале. Очигледно, такво стање ендометријума спречава стварање локалне имуносупресије у преимплантационом периоду, која је неопходна за формирање заштитне баријере и спречавање одбацивања полустраног фетуса.
У том смислу, пре трудноће, женама са уобичајеним побачајима треба дијагностиковати хронични ендометритис. Да би се утврдила или искључила ова дијагноза, биопсија ендометријума се врши 7.-8. дана менструалног циклуса са хистолошким прегледом, ПЦР и бактериолошким прегледом материјала из материчне дупље. Приликом верификације дијагнозе, хронични ендометритис се лечи према стандардима за лечење инфламаторних болести карличних органа.

