
Сви иЛиве садржаји су медицински прегледани или проверени како би се осигурала што већа тачност.
Имамо стриктне смјернице за набавку и само линкамо на угледне медијске странице, академске истраживачке институције и, кад год је то могуће, медицински прегледане студије. Имајте на уму да су бројеви у заградама ([1], [2], итд.) Везе које се могу кликнути на ове студије.
Ако сматрате да је било који од наших садржаја нетачан, застарио или на неки други начин упитан, одаберите га и притисните Цтрл + Ентер.
Улога промена у субхондралној кости у патогенези остеоартритиса
Медицински стручњак за чланак
Последње прегледано: 04.07.2025
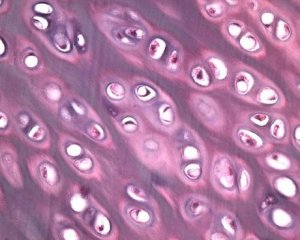
Уз дегенерацију зглобне хрскавице, и основно коштано ткиво је укључено у патолошки процес код остеоартрозе. Претпоставља се да задебљање субхондралне плоче доприноси прогресији остеоартрозе. Како остеоартроза напредује, зглобна хрскавица, која је подложна механичком и хемијском стресу, полако еродира због неравнотеже у процесима катаболизма и репарације хрскавице. Конкретно, механички стрес у односу на зглобове који „носе“ телесну тежину доприноси стварању великог броја микрофракутура у субхондралној плочи и хрскавици. Како зглобна хрскавица еродира, склероза субхондралне кости напредује, крутост коштаног ткива се повећава, што заузврат доприноси даљем нарушавању структуре зглобне хрскавице. Међутим, питање примарне или секундарне природе промена субхондралне кости код остеоартрозе остаје нерешено.
До недавно, радиографски детектне промене у сунђерастој супстанци субхондралне кости, попут склерозе или формирања цисте, сматране су секундарним код пацијената са остеоартрозом. Међутим, резултати клиничких и експерименталних студија указују на могућу почетну улогу субхондралне кости у патогенези остеоартрозе. Један од могућих механизама је нагло повећање градијента крутости субхондралне кости због чињенице да интегритет хрскавичног ткива које се налази испод ње зависи од механичких својстава њеног коштаног „легла“. Студије на приматима су показале да промене у субхондралној кости могу претходити променама у зглобној хрскавици. Докази за и против ове хипотезе који су се појавили као резултат студија на животињским моделима остеоартрозе и клиничких студија само су интензивирали дебату. Задебљање трабекула у субхондралној кости није увек праћено повећањем минерализације костију, односно повећањем запремине остеоида. Овај знак абнормалне минерализације указује на то да је поремећај регулације ремоделирања костију саставни део остеоартритиса и такође подржава концепт дефекта коштаних ћелија код остеоартритиса. Џ. Декекерова група (1989) сматра да је ово последње „генерализована метаболичка болест костију“.
Коштано ткиво се стално обнавља. Овај динамички процес, назван ремоделирање костију, представља сложен низ ресорпције и минерализације. Остеокласти ресорбују коштано ткиво, а остеобласти луче протеине који чине главну органску компоненту за минерализацију. Формирање и ресорпција костију се не дешавају насумично у целом скелету; то је програмирани процес који се одвија у различитим деловима скелета, названим јединице за ремоделирање костију. Рано у циклусу, остеокласти се појављују на неактивној површини; у року од 2 недеље, формирају тунел у кортикалној кости или лакуну на површини трабекуларне кости. Учесталост активације нових јединица за ремоделирање костију одређује степен обнове костију. Код здраве младе особе, процеси формирања и ресорпције костију су уравнотежени, а нормална коштана маса се одржава. У хормонској регулацији ресорпције коштаног ткива, најмање ПТХ и ПГЕ2 , учествују не само остеокласти већ и остеобласти, јер се под утицајем ових хормона ослобађају фактори који стимулишу ресорпцију костију остеокластима. Тренутно је познато више од 12 локалних и системских регулатора раста коштаног ткива који утичу на његово ремоделирање, посебно ПТХ, 1,25(OH)2D3 ,калцитонин, хормон раста, глукокортикоиди, тироидни хормони, инсулин, ИГФ (1 и 2), естрогени, ПГЕ2 , андрогени.
Коштане ћелије ослобађају бројне протеине и цитокине који врше ендокрину регулацију и пренос сигнала. Протеини које производе остеобласти укључују протеине коштаног матрикса као што су колаген, остеопонтин, остеокалцин, коштани сијалопротеини. Поред тога, ове ћелије ослобађају протеазе у активном и латентном облику које учествују у процесу ремоделирања коштаног ткива - ММП, компоненте система активатор плазминогена (ПА)/плазмин. Цитокини које ослобађају остеобласти могу деловати и путем аутокриних механизама и паракриних путева на локалне ћелије (други остеобласти, остеокласти).
Још увек није познато да ли су ови сигнали регулисани механичким стресом или другим хемијским сигналима изазваним механичким стресом. Међутим, познато је да поновљени механички стрес изазива локалну пролиферацију коштаних ћелија и/или протеина. Ин виво, механичко оптерећење може активирати остеобласте, повећати ниво цикличних нуклеотида, производњу простагландина и изазвати морфолошке промене повезане са ремоделирањем костију. Ин витро, механички стрес изазива пролиферацију остеобластних култура, експресију мРНК коштаних протеина укључених у формирање и минерализацију остеоида, ослобађање локалних фактора раста као што су IGF-1 и IGF-2 и молекуле адхезије. Пренос сигнала механичког стреса може се извршити путем механосензитивних јонских канала.
Постоје индиректни докази о дисфункцији остеобласта код остеоартрозе. Г. Геверс и Ј. Декекер (1987) су показали повећање нивоа остеокалцина у серуму код жена са остеоартрозом шаке, као и у кортикалним коштаним експлантима, што указује да патологија костију може бити део остеоартрозе. Аутопсија је открила не само задебљање субхондралне кости, већ и абнормално ниску минерализацију главе фемура. Код заморчића са хируршки изазваном остеоартрозом, компјутеризована томографија је открила значајно задебљање коштане фракције у субхондралној зони. Неравнотежа између колагенских и неколагенских (остеокалцин, итд.) протеина може довести до повећања запремине кости, али не утиче на њену минералну густину. Према М. Шимизу и др. (1993), прогресија дегенеративних промена у зглобној хрскавици повезана је са интензивнијим ремоделирањем субхондралне кости и повећањем њене крутости, што такође указује на дефект у ћелијама коштаног ткива код остеоартрозе. Према хипотези коју су предложили Б. Ли и М. Аспден (1997), пролиферација дефектних коштаних ћелија може довести до повећања крутости коштаног ткива, али не изазива повећање његове минералне густине.
Ц. И. Вестакот и др. (1997) поставили су хипотезу да абнормални остеобласти директно утичу на метаболизам хрскавице. Култивисањем остеобласта пацијената са остеоартритисом са хондроцитима људи који нису имали болести зглобова, аутори су приметили значајну промену у ослобађању гликозаминогликана од стране нормалног хрскавичног ткива in vitro, али је ниво ослобађања цитокина остао непромењен. Г. Хилал и др. (1998) показали су да култура остеобласта из субхондралне кости пацијената са остеоартритисом in vitro има измењен метаболизам - активност АП/плазмин система и ниво IGF-1 у овим ћелијама су повећани. Запажање Ц. И. Вестакота и др. (1997) може се објаснити повећањем активности протеаза у ћелијама субхондралне кости.
Остаје непознато да ли промене у субхондралној кости покрећу остеоартритис или доприносе његовој прогресији. Д. К. Дедрик и др. (1993) су показали да код паса са хируршки изазваним остеоартритисом, задебљање субхондралне кости није неопходан услов за развој промена сличних остеоартрози у зглобној хрскавици, али доприноси прогресији дегенеративних процеса у хрскавици. Резултати студије А. Са'иеда и др. (1997) противрече подацима претходне студије. Користећи ехографију од 50 MHz за процену почетних морфолошких промена и њихове прогресије у зглобној хрскавици и кости код експерименталног остеоартритиса изазваног ињекцијама монојодосирћетне киселине у коленски зглоб пацова, аутори су показали истовремени процес промена у костима и хрскавицама током прва три дана након ињекције.
Остеобласти луче факторе раста и цитокине који учествују у локалном ремоделирању костију, што може подстаћи ремоделирање правилне хрскавице у „носећим“ зглобовима након њиховог продирања кроз микропукотине у калцификованом слоју зглобне хрскавице. Штавише, секреторни продукти коштаних ћелија налазе се у синовијалној течности. Највероватнији производи које луче абнормални остеобласти, а који могу покренути процес локалног ремоделирања хрскавице, су TGF-β и протеини морфометрије костију (BMP). Оба члана породице TGF луче и хондроцити и остеобласти, и оба су способна да модификују ремоделирање и костију и хрскавице. J. Martel Pelletier et al. (1997) су приметили повећање нивоа TGF-β у субхондралним коштаним експлантатима пацијената са остеоартрозом у поређењу са здравим особама, што указује на вероватну улогу овог фактора раста у патогенези остеоартрозе. IGF-ове такође производе остеобласти. У култури ћелија сличних остеобластима добијених од пацијената са остеоартрозом, пронађено је повећање нивоа ИГФ-а, који мењају метаболизам хрскавице.
TGF-b, IGF, BMP и цитокини које производе остеобласти у субхондралној кости могу утицати на производњу колагеназе и других протеолитичких ензима у хрскавици, што заузврат може подстаћи ремоделирање/деградацију хрскавичаве матрице. Остаје нејасно да ли остеобласти код остеоартритиса производе мање фактора који стимулише колоније макрофага (M-CSF - стимулатор ресорпције костију) него нормалне ћелије. Резултати студија АГ Уитерлиндена и др. (1997) показали су да рецептори витамина D, које експресују остеобласти и регулишу експресију бројних фактора које синтетишу ове ћелије, могу играти одређену улогу у формирању остеофита, што делимично објашњава улогу остеобласта у патогенези ове болести.
Узимајући у обзир резултате горе наведених студија, Г. Хилал и др. (1998), Ј. Мартел-Пелетје и др. (1997) предложили су следећу радну хипотезу о вези између ремоделирања субхондралне кости и правилне зглобне хрскавице код остеоартрозе. У раној или узнапредовалој фази патогенезе остеоартрита, процес ремоделирања коштаног ткива у субхондралној кости се интензивира. Истовремено, поновљено оптерећење доводи до локалних микрофракута и/или појаве неравнотеже у систему IGF/IGF-везујући протеин (IGFBP) услед абнормалног одговора остеобласта субхондралне кости, што доприноси њеној склерози. Потоње заузврат може допринети појави микрофракута правилне хрскавице и оштећењу њеног матрикса.
Под нормалним условима, ова оштећења се поправљају локалном синтезом и ослобађањем IGF-1 и IGF-везујућег протеина, који стимулишу формирање ECM зглобне хрскавице. Истовремено, GF-систем подстиче раст субхондралних коштаних ћелија и формирање коштаног матрикса. Анаболичка активност IGF-система је повећана у субхондралној кости пацијената са остеоартрозом, док локална активација AP/плазмин система (локални регулатор IGF-система) у зглобној хрскавици изазива њене локалне промене. У остеобластима код остеоартрозе, IGF-1 ремети регулацију AP плазмином типом позитивне повратне спреге, стога може ограничити ремоделирање у коштаном ткиву, што на крају доводи до субхондралне склерозе. Дакле, у коштаном и хрскавичном ткиву, локална индукција IGF-1 и протеаза доводи, с једне стране, до оштећења хрскавице, а с друге стране до субхондралног задебљања костију, што заузврат доприноси даљем оштећењу хрскавице. Неравнотежа између оштећења хрскавице повезаног са субхондралном склерозом и њених репаративних способности доводи до прогресивних промена у хрскавичном ECM-у и до развоја остеоартрозе. Према ауторима, ова хипотеза такође објашњава споро напредовање болести.

