
Сви иЛиве садржаји су медицински прегледани или проверени како би се осигурала што већа тачност.
Имамо стриктне смјернице за набавку и само линкамо на угледне медијске странице, академске истраживачке институције и, кад год је то могуће, медицински прегледане студије. Имајте на уму да су бројеви у заградама ([1], [2], итд.) Везе које се могу кликнути на ове студије.
Ако сматрате да је било који од наших садржаја нетачан, застарио или на неки други начин упитан, одаберите га и притисните Цтрл + Ентер.
Лекови који спречавају тромбозу и побољшавају реологију крви
Медицински стручњак за чланак
Последње прегледано: 07.07.2025
У спречавању стварања вишеструких микротромба током шока и њиховог уништавања, могу се користити различити фармаколошки приступи који користе лекове који спречавају стварање тромба и побољшавају реологију крви:
- елиминација системских хемодинамских и микроциркулационих поремећаја употребом вазоактивних и инотропних средстава;
- мере за побољшање реологије крви коришћењем рационалне инфузионе терапије и лекова који обнављају еластичност еритроцитних мембрана (трентал или пентоксифилин);
- спречавање агрегације тромбоцита и формирање почетних „белих“ тромба у малим артеријским судовима са накнадним покретањем каскаде коагулације;
- инхибиција стварања тромба након активације системске каскаде коагулације;
- активација фибринолизе са циљем растварања новостворених крвних угрушака (фибринолизин, стрептокиназа, стрептодеказа, урокиназа итд.) или, напротив, инхибиција фибринолизе када је генерализована код неких пацијената са трауматским шоком и сепсом (аминокапроинска киселина, амбен, контрикал итд.).
Већина наведених приступа су традиционални, добро развијени у пракси лечења шока, имају своје хемореолошке индикације и наведени су у одговарајућим поглављима. Стога је у овом одељку препоручљиво задржати се на разматрању општег приступа превенцији стварања тромба у шоку употребом фармаколошких средстава која утичу на профазу коагулације крви. Управо тај ниво превенције компликација коагулације - појава, формирање и раст „белих артеријских тромба“ - привлачи највећу пажњу истраживача.
Различити типови шока карактеристични су за различите врсте шока, а често и вишесмерни поремећаји коагулације крви са погоршањем њене реологије. Најкарактеристичнији за септички, ендотоксински, опекотински, трауматски и хеморагични тип шока је формирање вишеструких микротромба у најмањим крвним судовима, узроковано поремећајима системске хемодинамике, вазоспазмом и поремећајима микроциркулације, згушњавањем крви, муљем, смањеном еластичношћу мембрана еритроцита, као и бројним општим и локалним факторима (аутокоидима) који покрећу локалне промене у коагулационој хемостази и укључивањем профазе коагулације крви.
У шематском (скраћеном) облику, почетна фаза хемокоагулације и механизам локалне хомеостазе хемокоагулације представљени су на следећи начин.
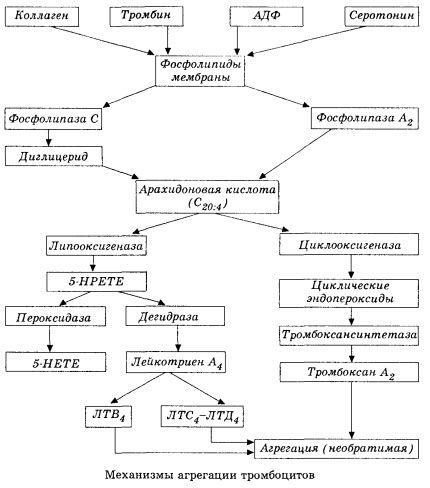
Почиње активацијом мембранске фосфолипазе А2 као резултат утицаја комбинације штетних фактора (директно оштећење мембране, хипоксија, липидна пероксидација, утицај ендогених хемијских фактора итд.). Као резултат разградње мембранских фосфолипида, ослобађају се неестерификоване масне киселине дугог ланца, од којих је арахидонска киселина најважнија као почетни супстрат. Њена трансформација (каскада арахидонске киселине) одвија се путем липоксигеназног (синтеза леукотриена) и циклооксигеназног (синтеза простагландина, тромбоксана, простациклина) путева.
Добијени леукотриени (Б4, Ц4, Е4, Д4, итд.) - супстанце са изузетно високом биолошком активношћу, које укључују споро реагујућу супстанцу анафилаксије - имају велики значај у покретању локалних васкуларних, инфламаторних и имуних реакција, укључујући аутоимуне процесе. Леукотриени изазивају поремећаје микроциркулације, повећано згрушавање крви, ослобађање аутолитичких лизозомалних ензима и ослобађање у крв фактора који инхибира контрактилност миокарда и бронхијални спазам.
Због своје способности да изазову контракцију глатких мишића, леукотриени значајно утичу на системску хемодинамику, коронарне судове и миокард, вршећи снажан коронарни констрикторни и негативни инотропни ефекат, што је праћено смањењем срчаног излаза и игра важну улогу у развоју хипотензије.
Смањени срчани излаз и хипотензивни одговор на леукотриене повезани су са слабљењем срчаног мишића и ограничавањем венског повратка у срце. Од значајног значаја у ограничавању венског повратка је способност леукотриена да повећају пропустљивост васкуларног зида и изазову екстравазацију плазме. Леукотриени се сматрају важним у патогенези инфаркта миокарда.
Код анафилактичког и септичког (ендотоксинског) шока, њихова улога очигледно још више расте, што доказује способност леукотриена да се акумулирају у значајним количинама у плазми током алергијских реакција и да изазову промене у системском протоку крви карактеристичне за анафилактички шок, као и заштитни ефекти блокатора леукотриенских рецептора и инхибитора липоксигеназе. Развој селективних блокатора леукотриенских рецептора спроводи се прилично интензивно и представља обећавајући правац науке. У овој области већ је постигнут извесни успех и експериментално је потврђена ефикасност таквих блокатора код миокардне исхемије, ендотоксинског и хеморагичног шока. Међутим, вероватно ће бити потребно још неколико година пре него што се овај правац клинички имплементира.
Ако се у венским судовима тромби формирају уз једнако учешће тромбоцита и плазма фактора коагулације, онда су у артеријама тромбоцити главни покретачи процеса. Они садрже АДП, Ца2+, серотонин, фосфолипиде, ензиме синтезе простагландина и тромбоксана, тромбостенин (као и мишићни актомиозин, обезбеђује контрактилну способност ових ћелија), тромбогени фактор раста епитела и мишићних ћелија васкуларног зида и низ других супстанци. Хуморална регулација функција тромбоцита врши се преко специјализованих рецептора њихових мембрана (алфа2- и бета2-адренорецептори, рецептори за хистамин и серотонин, ацетилхолин, тромбоксан, аденозин и низ других). Посебно својство тромбоцита је висок афинитет за колаген и друге субендотелне елементе васкуларног зида, за површине које се не квасе и негативно наелектрисане. Ово својство пружа тромбоцитима изузетну способност да се прилепе (адхезију) за део суда са оштећеним ендотелом, који има велике могућности да се оштети током шока. У овом случају, тромбоцити се шире и ослобађају псеудоподије, које се могу прилепити једна за другу и за зид крвног суда. Пропустљивост мембране се повећава, а АДП, серотонин, тромбоксан и неки фактори коагулације адсорбовани на површини тромбоцита ослобађају се из тромбоцита. Ове супстанце интерагују са одговарајућим рецепторима на мембрани и, уз учешће калцијумових јона, изазивају агрегацију (у почетку реверзибилну). Процес постаје самоодржив, што је олакшано хуморалним регулаторним факторима; други фактори, напротив, могу га зауставити, па чак и обрнути, узрокујући дезагрегацију.
Са превлашћу утицаја и услова који стварају тромбе, фазе адхезије и реверзибилне агрегације замењују се трећом фазом - иреверзибилном агрегацијом, која се спроводи уз учешће тромбостенина и доводи до сужења угрушка; реакција јачања агреганта и сужења се такође одвија уз учешће Ca+, АТП-а и доводи до стварања белог тромба.
Циклооксигеназни пут конверзије арахидонске киселине у тромбоцитима, васкуларним ендотелним ћелијама и другим ткивима обезбеђује локалну (полуживот метаболита је веома кратак) коагулациону хомеостазу, будући да се током овог метаболизма формирају снажне про- и антиагрегантне супстанце. Главни фактор који активира агрегацију тромбоцита у циклооксигеназном ланцу реакција је тромбоксан А2, а његов не мање снажан антагонист је простациклин, који производе ендотелне ћелије и, у мањој мери, простагландини Е и Г серије. Коначно, на агрегацију тромбоцита снажно утичу додатни локални и системски хуморални фактори.
Активатори и инхибитори агрегације тромбоцита
Иницијатори и активатори агрегације тромбоцита |
Инхибитори агрегације тромбоцита |
Колаген |
- |
АДП |
Аденозин и његови стабилизатори |
Норепинефрин (преко алфа2 рецептора) |
Алфа-адренергички блокатори |
Серотонин |
Антисеротонински агенси |
Хистамин |
Антихистаминици |
Тромбин |
Хепарин |
Ca2+ |
Антагонисти Ca2+ |
CGMP - његови индуктори (ацетилхолин?) и стабилизатори |
КАМ - његови индуктори (преко бета-адренергичких рецептора) и стабилизатори (инхибитори фосфодиестеразе) |
Арахидонска киселина |
Декстрани, албумин |
Тромбоксан А2 |
Простациклин I2 |
Фармаколошке интервенције у почетној фази формирања тромба код шока и акутних исхемијских процеса у срцу и мозгу указују на следећу могућност:
- инхибиција почетних реакција (тоталних и делимичних) каскаде арахидонске киселине;
- инхибиција одређене реакције синтезе тромбоксана;
- блокада рецептора за леукотриене и тромбоксане у тромбоцитима, глатким мишићима и другим ћелијама;
- употреба супстанци које модулирају агрегацију тромбоцита, односно на друге начине слабе реакцију овог другог на утицај иницијаторских фактора (колаген, тромбоксан А2, леукотриени итд.).
Спровођење наведених начина корекције поремећаја реолошких својстава крви обезбеђује решавање главног тактичког задатка: заштитити рецепторе агрегације и адхезије тромбоцита од дејства активатора или сузбити интрацелуларне механизме синтезе ових рецептора. Инхибиција почетних реакција каскаде арахидонске киселине може се постићи заштитом рецептора тромбоцита који реагују на полимерне активаторе, коришћењем нискомолекуларних декстранова, чији молекули конкуришу фибрину, колагену, агрегираном имуноглобулину (IgE) и компонентама система комплемента.
Маскирањем рецептора на мембрани тромбоцита и конкурисањем са великодиспергованим протеинима на површини еритроцита, нискомолекуларни декстран их истискује и уништава мостове између ћелија. То је због чињенице да декстран, обавијајући васкуларни ендотел и површину ћелијских елемената крви, повећавају њихово негативно наелектрисање, чиме се појачавају антиагрегациона својства.
Декстранс
Декстрани мале молекулске тежине смањују агрегацију тромбоцита изазвану колагеном и АДП-ом, као и активирајући ефекат тромбина на тромбоците, инхибирају раст почетног белог тромбоцитног тромба, побољшавају проток крви, смањују постоперативно повећање садржаја фибриногена у плазми и мењају структуру и стабилност фибрина.
Интравенске инфузије декстрана код трауме и шока не само да смањују агрегацију и адхезију тромбоцита, већ и мобилишу ендогени хепарин, чиме се подстиче стварање растреситог и слабо ретрактабилног крвног угрушка, који се лако лизира фибринолитицима. Антитромбинска активност нискомолекуларних декстрана повезана је са њиховим специфичним дејством на структуру и функцију фактора коагулације крви VIII. Фактор VIII (антихемофилни глобулин), велики молекул са сложеном структуром и функцијом, укључен је у агрегацију тромбоцита и стабилност резултујућег угрушка. Декстран омета дејство фактора VIII, чиме успорава агрегацију тромбоцита и смањује стабилност угрушка.
Декстрани мале молекулске тежине нису прави антикоагуланси и њихов корективни ефекат код хемореолошких поремећаја повезан је углавном са хемодилуцијом, надокнадом волумена циркулишуће плазме и побољшањем протока крви у систему микроциркулације.
Способност декстрана да побољшају проток крви код хемодинамских поремећаја (шок, губитак крви) последица је комплекса фактора. Појава високе пролазне концентрације полимера у крви не само да доводи до „директне хемодилуције“, већ ствара услове за проток течности у крвоток из интерстицијалног простора и накнадно уравнотежење осмотског ефекта декстрана. Као последица хемодилуције, смањује се вискозност крви, повећава се венски прилив у срце и повећава се срчани излаз. Уз ове ефекте, декстран формира комплексе са фибриногеном и има антилипемијски ефекат.
Дакле, антиагрегационо дејство и хемодинамски ефекти нискомолекуларних декстрана помажу у смањењу вискозности крви, што је посебно важно при ниским брзинама смицања. Дисагрегација крвних ћелија побољшава системски проток крви и микроциркулацију, посебно у њеном венском делу, где су градијенти брзине најнижи. Употреба нискомолекуларних декстранских раствора код различитих врста шока, током хируршког лечења повреда и њихових последица, а затим и у постоперативном периоду помаже у спречавању хиперкоагулације и смањењу вероватноће тромботичних процеса и емболије.
Међутим, треба напоменути да су у неким случајевима инфузије раствора декстрана праћене анафилактичким и алергијским реакцијама (опасно у присуству сензибилизације и анафилактичког шока). То је због чињенице да декстрани, који имају велику молекулску тежину и много бочних ланаца, могу деловати као антиген. Стога се, ради утврђивања индивидуалне осетљивости, препоручује претходна интравенска примена до 20 мл нискомолекуларног раствора декстрана као хаптена (15% раствор, молекулска тежина 1000) и спровођење инфузија плазма супституента пре увођења анестезије.
 [ 9 ], [ 10 ], [ 11 ], [ 12 ], [ 13 ], [ 14 ], [ 15 ], [ 16 ], [ 17 ], [ 18 ]
[ 9 ], [ 10 ], [ 11 ], [ 12 ], [ 13 ], [ 14 ], [ 15 ], [ 16 ], [ 17 ], [ 18 ]
Инхибитори тромбина
Фармаколошка заштита рецептора тромбоцита који интерагују са активаторима тромбоцита може се постићи и употребом средстава која се такмиче са неполимерним активаторима тромбоцита или их инхибирају. Таква средства укључују инхибиторе тромбина (хепарин и хирудин, бројни синтетички инхибитори, антагонисти адреналина), блокаторе алфа-рецептора (фентоламин, дихидроерготамин), антагонисте АДП-а (дипиридамол, аденозин и његови структурни аналози, фосфокреатин), антагонисте серотонина (метисергид). Само неколико наведених средстава се заправо користи за превенцију и терапију шока различитог порекла.
Заштита интрацелуларних механизама синтезе протеинских рецептора који реагују са активаторима агрегације и адхезије тромбоцита, и инхибиција процеса синтезе тромбоксана могући су лековима различитих група:
- индуктори и стабилизатори цАТП-а, простациклина и простагландина ПгЕ2;
- инхибитори фосфолипазе и фосфодиестеразе.
Интензиван развој специјалних антитромбоцитних средстава почео је релативно недавно и још увек није довео до поузданих резултата. Тренутно се у клиничкој пракси, поред декстранских раствора, широко користе антитромбоцитни агенси као што су ацетилсалицилна киселина, индометацин, дипирадамол, сулфинпиразон (персантин), простациклин (еикопростенон) и хепарин за спречавање стварања белих тромбоцитних тромба.
Нестероидни антиинфламаторни лекови
Утврђено је да су фармаколошки ефекти нестероидних антиинфламаторних лекова - ацетилсалицилне киселине и индометацина - последица њиховог дејства на метаболизам еикозаноида (тромбоксана и простагландина). Готово сви лекови у овој групи инхибирају ензимски комплекс познат као простагландин синтетаза, чиме испољавају своје специфичне и антиагрегантне ефекте.
Ацетилсалицилна киселина се веома брзо апсорбује након оралне примене. Производ њене хидролизе, салицилна киселина, изазива инхибицију тромбоцитне циклооксигеназе, што ремети конверзију арахидонске киселине у простагландин О2 и, на крају, тромбоксан А2. Ацетилсалицилна киселина инхибира агрегацију изазвану колагеном, АДП-ом, адреналином и серотонином. Иако је њена ГГ05 вредност 15 минута, антиагрегантни ефекат траје неколико дана, што се очигледно објашњава неповратном инхибицијом реакција синтезе простагландина и сузбијањем функције агрегације тромбоцита током целог њиховог животног века (6-10 дана). Уз инхибицију тромбоцитне циклооксигеназе, ацетилсалицилна киселина у високим дозама инхибира циклооксигеназу васкуларног зида и истовремено са сузбијањем синтезе тромбоксана А2 инхибира синтезу простациклина у ендотелним ћелијама. Стога, ацетилсалицилну киселину треба прописивати као антиагрегант у малим дозама (3000-5000 мг/дан), које претежно инхибирају агрегацију тромбоцита.
С обзиром на то да ацетилсалицилна киселина блокира тромбоцитну циклооксигеназу неколико дана, а ендотелну циклооксигеназу - не више од једног дана, рационално је преписивати лек не свакодневно, већ свака 3-4 дана. Избор оптималне дозе ацетилсалицилне киселине за пацијента треба вршити индивидуално, јер постоји различита осетљивост пацијената на антитромбоцитни ефекат лека. Код реактивних пацијената, ацетилсалицилна киселина у дози од 0,5 г инхибира агрегацију тромбоцита за 40-50%, код хиперреактивних пацијената - потпуно или за 80-90%, а за реактивне пацијенте карактеристично је одсуство антитромбоцитног ефекта при узимању исте дозе лека.
Селективни инхибитори тромбоксан синтетазе су имидазол и његови аналози, који не блокирају циклооксигеназу. Дипиридамол, који се користи у клиничкој пракси у лечењу хроничне исхемијске болести срца као коронарни дилататор, попут имидазола, селективно инхибира тромбоксан синтетазу, спречавајући синтезу тромбоксана А2. Верује се да лек и његови аналози такође инхибирају тромбоцитну фосфодиестеразу, чиме повећавају концентрацију цАМП-а у тромбоцитима. Уз то, дипиридамол инхибира активност аденозин деаминазе и апсорпцију аденозина од стране тромбоцита, блокира апсорпцију серотонина од стране тромбоцита и њихову агрегацију изазвану адреналином и колагеном. Постоје извештаји о слабој антитромбоцитној активности лека и његовој способности у малим дозама да појача агрегацију тромбоцита. Најпоузданији антитромбоцитни ефекат може се постићи комбинацијом дипиридамола и ацетилсалицилне киселине.
Хепарин
Међу антитромботичким средствима, један од најефикаснијих регулатора агрегатног стања крви је хепарин, посебно када се користи рано. Хепарин има високо негативно наелектрисање и способан је да интерагује и са великим и са малим јонима и молекулима (ензими, хормони, биогени амини, протеини плазме итд.), тако да је спектар његовог биолошког дејства прилично широк. Лек има антитромбинско, антитромбопластинско и антипротромбинско дејство, спречава конверзију фибриногена у фибрин, сузбија ретракцију угрушка и повећава фибринолизу.
Механизам антикоагулантног дејства хепарина је прилично сложен. Сада је утврђено да су антикоагулантни ефекти хепарина повезани са појачавањем дејства антитромбина III и повећањем способности комплекса хепарин-антитромбин III да брзо инактивира већину серинских протеаза система коагулације крви. У антитромботском дејству хепарина, од великог значаја је његова способност да повећа и одржи висок електронегативни потенцијал васкуларне интиме, спречавајући адхезију тромбоцита и стварање микротромба тромбоцита. Хепарин најактивније сузбија стварање тромба у венама, спречавајући и локално стварање тромба и дисеминовану интраваскуларну коагулацију.
Простациклин и његови стабилни аналози
Међу антитромбоцитним средствима, најмоћнији инхибитори агрегације су простациклин и његови стабилни аналози. Антитромбоцитни ефекат простациклина је последица стимулације аденилат циклазе и, као последица тога, повећања концентрације цАМП у тромбоцитима, смањења садржаја тромбоксана, смањења садржаја тромбоксана А2 и блокаде његових рецептора. Простациклин је нестабилан и брзо се хидролизује до неактивних производа, па се примењује интравенозно кап по кап брзином од 2 до 20 нг/кг у минути током 30-60 минута до 6 пута дневно.
Простациклин, уз јако антиагрегационо дејство, има снажан вазодилататорни и бронходилататорни ефекат. Лек шири судове мозга, срца, бубрега, скелетних мишића и мезентеричних судова. Под утицајем простациклина повећава се коронарни проток крви, повећава се снабдевање миокарда енергијом и смањује се његова потреба за кисеоником. Упркос његовој нестабилности у организму, клинички повољни ефекти могу трајати неколико недеља, па чак и месеци. Механизам таквог продуженог дејства још увек није јасан.
Простациклин је лек са ниским садржајем токсина, али његова употреба може изазвати нежељене ефекте: црвенило лица, главобоље, смањен крвни притисак, бол у стомаку, анорексију. Заједно са простациклином, његови синтетички стабилни аналози (илопрост, итд.) су обећавајући инхибитори агрегације тромбоцита.
Лекови који побољшавају вискозност крви
Поремећаји реолошких својстава крви током трауме и шока узроковани су не само променама функционалне активности тромбоцита, већ и повећањем вискозности крви. Структурна вискозност крви као сложеног динамичког диспергованог система у великој мери је одређена вискозношћу плазме и способношћу еритроцита да се деформишу. Вискозност плазме зависи углавном од концентрације протеина у крви. Протеини са малом молекулском тежином, као што је албумин, имају мали утицај на вискозност плазме, док протеини са великим молекулом (фибриноген, алфа- и гама-глобулини, други макромолекули) је значајно повећавају.
При ниским брзинама смицања, адсорпција фибриногена и глобулина на површини еритроцита доводи до формирања мостова између суседних ћелија и формирања агрегата из еритроцита. Брзина формирања агрегата је сложен биофизички процес и зависи не само од величине смицања, већ и од електрокинетичких својстава еритроцита, концентрације, масе и сорпционог капацитета макромолекула-агрегатора, од облика и пластичности еритроцита.
Одржавање облика и механичких својстава еритроцитне мембране захтева значајан утрошак енергије. Сматра се да се енергија произведена у еритроцитима током гликолизе троши на фосфорилацију спектрина, што резултира променама у секундарној структури протеина и интеракцијом са суседним компонентама унутрашње мембране. Интеракција између структурних протеина мембране, спектрина и актина, игра важну улогу у формирању механичких својстава еритроцитне мембране, у одржавању константне површине еритроцита и његове дебљине при било којој деформацији.
Код системских хемодинамских и органских поремећаја крвотока, повећање крутости еритроцитних мембрана и формирање еритроцитних агрегата доводи до смањења брзине проласка еритроцита кроз капиларе, чиме се нарушава функција транспорта гасова у крви. Стога, корекција поремећаја реолошких својстава крви у шоку треба да обухвати, уз спречавање агрегације еритроцита, нормализацију вискозности плазме и крви, агрегацију и деформацију еритроцита.
Поред нискомолекуларних декстрана, раствори албумина су једно од ефикасних средстава за повећање стабилности суспензије крви. У касном периоду шока, генерализована агрегација еритроцита се јавља на позадини смањења концентрације албумина у крвној плазми и повећања концентрације фибриногена и глобулина, посебно алфа2 фракције, липопротеина и липида. Под овим условима, реолошки ефекти албумина су последица два главна фактора: хемодилуције и нормализације односа између микро- и макроглобуларних протеина у плазми. Истовремено, албумин везује слободне киселине, чија лабилизација током трауме и шока стимулише агрегацију ћелијских структура крви и интраваскуларну коагулацију и може изазвати масну емболију.
Антишокне мере усмерене на надокнаду волумена циркулишуће крви, елиминисање ткивне хипоксије и метаболичке ацидозе, доприносе нормализацији еластичности еритроцитних мембрана, будући да хипоксија и ацидоза значајно смањују деформабилност еритроцита. Повећана крутост еритроцитних мембрана у шоку вероватно је повезана са инхибицијом синтезе АТП-а у еритроцитима. Заузврат, смањење концентрације АТП-а доприноси повећању концентрације Ca2+ у еритроцитима, који, везивањем за мембранске протеине, повећава крутост мембране.
Један од фармаколошких лекова који повећава садржај АТП-а у еритроцитима и еластичност еритроцитних мембрана је Трентал (пентоксифилин), који се користи у клиничкој пракси за лечење исхемијских поремећаја.
Уз смањење крутости еритроцитних мембрана, Трентал изазива вазодилатацију, побољшава оксигенацију ткива, инхибира активност фосфодиестеразе у ткивима, повећава концентрацију цАМП-а и инхибира агрегацију тромбоцита.
Међу осталим фармаколошким средствима која одржавају еластичност еритроцитне мембране, вреди напоменути антагонисте Ca2+, који ограничавају проток јона у еритроците (флунаризин, нифедипин, итд.).
 [ 19 ], [ 20 ], [ 21 ], [ 22 ], [ 23 ], [ 24 ], [ 25 ], [ 26 ], [ 27 ]
[ 19 ], [ 20 ], [ 21 ], [ 22 ], [ 23 ], [ 24 ], [ 25 ], [ 26 ], [ 27 ]
Пажња!
Да бисте поједноставили перцепцију информација, ова упутства за употребу дроге "Лекови који спречавају тромбозу и побољшавају реологију крви" су преведена и представљена у посебном облику на основу званичних упутстава за медицинску употребу лека. Пре употребе прочитајте примедбу која је долазила директно на лек.
Опис обезбеђен у информативне сврхе и није водич за самоделивање. Потреба за овим леком, сврху режима лечења, метода и доза лека одређује само лекар који присуствује. Само-лек је опасан за ваше здравље.

