
Сви иЛиве садржаји су медицински прегледани или проверени како би се осигурала што већа тачност.
Имамо стриктне смјернице за набавку и само линкамо на угледне медијске странице, академске истраживачке институције и, кад год је то могуће, медицински прегледане студије. Имајте на уму да су бројеви у заградама ([1], [2], итд.) Везе које се могу кликнути на ове студије.
Ако сматрате да је било који од наших садржаја нетачан, застарио или на неки други начин упитан, одаберите га и притисните Цтрл + Ентер.
Нови генетски механизми могу пружити терапеутску мету против глиома
Последње прегледано: 02.07.2025
Студија из лабораторије др Ши-Јуан Ченга, професора на Одељењу за неуро-онкологију Кена и Рут Дејви на Катедри за неурологију, идентификовала је нове механизме који леже у основи алтернативних догађаја сплајсинга РНК у ћелијама тумора глиома, који могу послужити као нове терапијске мете. Резултати студије објављени су у часопису Journal of Clinical Investigation.
„Пронашли смо другачији начин лечења глиома кроз призму алтернативног сплајсинга и открили нове циљеве који раније нису идентификовани, али су важни за малигнитет глиома“, рекао је др Сјао Сонг, ванредни професор неурологије и главни аутор студије.
Глиоми су најчешћи тип примарног тумора мозга код одраслих и потичу од глијалних ћелија, које се налазе у централном нервном систему и подржавају суседне неуроне. Глиоми су веома отпорни на стандардне третмане, укључујући зрачење и хемотерапију, због генетске и епигенетске хетерогености тумора, што истиче потребу за проналажењем нових терапијских циљева.
Претходно истраживање из лабораторије Ченг, објављено у часопису Cancer Research, показало је да је важан фактор сплајсинга SRSF3 значајно повишен код глиома у поређењу са нормалним мозгом, а SRSF3-регулисано сплајсинг РНК подстиче раст и прогресију глиома утицајем на вишеструке ћелијске процесе у туморским ћелијама.
Спајање РНК је процес који укључује уклањање интрона (некодирајућих региона РНК) и спајање егзона (кодирајућих региона) да би се формирао зрели молекул мРНК који подржава експресију гена у ћелији.
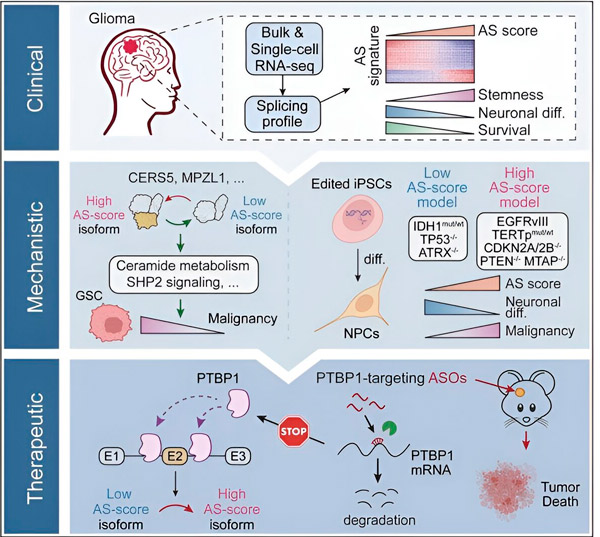
У овој студији, научници су имали за циљ да идентификују промене у алтернативном сплајсингу у ћелијама тумора глиома, механизме који леже у основи ових промена и да одреде њихов потенцијал као терапијских мета.
Користећи рачунарске методе и технологије секвенцирања РНК, истраживачи су испитали промене у сплајсингу у ћелијама тумора глиома из узорака пацијената. Да би потврдили ове промене, користили су CRISPR технологије за уређивање гена како би увели различите мутације глиомских драјвера у моделе глиома изведене из људских индукованих плурипотентних матичних ћелија (iPSC).
Открили су да су ове промене спајања појачане варијантом рецептора епидермалног фактора раста III (EGFRIII), за који се зна да је прекомерно експримиран у многим туморима, укључујући глиоме, а инхибира га мутација у гену IDH1.
Истраживачи су потврдили функцију два догађаја спајања РНК који стварају различите изоформе протеина са различитим секвенцама аминокиселина.
„Само једна од ових изоформи може да подстакне раст тумора, за разлику од друге изоформе, која се нормално експресује у нормалном мозгу. Тумори користе овај механизам да селективно експресују изоформу која подстиче раст тумора у односу на изоформу нормалног мозга“, рекао је Сонг.
Тим је затим анализирао узводне протеине који везују РНК и открио да ген PTBP1 регулише сплајсинг РНК који подстиче тумор у ћелијама глиома. Користећи ортотопски модел глиома код имунодефицијентних мишева, истраживачи су циљали PTBP1 терапијом заснованом на антисенс олигонуклеотидима (ASO), што је на крају сузбило раст тумора.
„Наши подаци истичу улогу алтернативног сплајсинга РНК у утицају на малигнитет и хетерогеност глиома и његов потенцијал као терапеутске рањивости за лечење одраслих глиома“, написали су аутори студије.
Следећи корак за истраживаче је да истраже потенцијал циљања ПТБП1 како би се изазвао антитуморски имуни одговор, рекао је Сонг.
„Користећи анализу секвенцирања РНК дугог читања, открили смо да циљање ПТБП1 у ћелијама глиома резултира производњом вишеструких алтернативно сплајсованих транскрипата који су одсутни у нормалним ткивима. Дакле, наш следећи пројекат је да откријемо да ли ова изоформа може генерисати неке антигене тако да имуни систем може боље препознати тумор“, рекао је Сонг.
Сонг је такође додао да је њихов тим заинтересован за анализу промена спајања у нетуморским ћелијама код пацијената са глиомом, као што су имуне ћелије.
„Већ знамо да је сплајсинг веома важан за регулисање функције у ћелији, тако да не би требало само да регулише малигнитет тумора, већ може и да регулише функцију имуних ћелија како би се утврдило да ли могу ефикасно да униште рак. Зато такође радимо неке биоинформатичке анализе у имуним ћелијама инфилтрираним тумором како бисмо видели да ли постоји промена у сплајсингу након што је имуна ћелија инфилтрирала тумор.“
"Наш циљ је да утврдимо улогу алтернативног спајања у обликовању имуносупресивног туморског микроокружења и да идентификујемо потенцијалне циљеве за побољшање ефикасности имунотерапија код глиома", рекао је Сонг.
