
Сви иЛиве садржаји су медицински прегледани или проверени како би се осигурала што већа тачност.
Имамо стриктне смјернице за набавку и само линкамо на угледне медијске странице, академске истраживачке институције и, кад год је то могуће, медицински прегледане студије. Имајте на уму да су бројеви у заградама ([1], [2], итд.) Везе које се могу кликнути на ове студије.
Ако сматрате да је било који од наших садржаја нетачан, застарио или на неки други начин упитан, одаберите га и притисните Цтрл + Ентер.
Лек LM11A-31 успорава прогресију Алцхајмерове болести у испитивању
Последње прегледано: 02.07.2025

У недавној студији објављеној у часопису Nature Medicine, научници су спровели рандомизовану, двоструко слепу, плацебо контролисану студију фазе 2а како би испитали безбедност и ефикасност LM11A-31 у лечењу Алцхајмерове болести (АБ) путем модулације рецептора неуротрофина p75 (p75NTR).
Алцхајмерова болест са касним почетком је најчешћи облик деменције, карактерисан синаптичким отказивањем, дегенерацијом и губитком нервних ћелија. Иако два водећа лека за лечење Алцхајмерове болести циљају акумулацију абнормалних амилоид-β или тау протеина, они се баве само делом патофизиологије. Други приступ укључује циљање рецептора и сигналних мрежа које утичу на фундаменталне биолошке путеве. Преклиничке студије показују да модулација p75NTR новим малим хемијским молекулом, LM11A-31, смањује синаптички губитак изазван амилоидом и абнормалним тау протеином.
Опис студије
У овом рандомизованом клиничком испитивању, истраживачи су испитали да ли LM11A-31 може успорити прогресију Алцхајмерове болести модулирањем p75NTR код људи.
Учесницима студије дате су оралне капсуле LM11A-31 у дозама од 200 мг и 400 мг или плацебо у односу 1:1:1 код 242 пацијента са благом до умереном астмом током 26 недеља. Учесници су имали биолошки потврђену Алцхајмерову болест (ниво амилоидног β протеина 42 (Aβ42) у цереброспиналној течности испод 550 нг/Л или однос Aβ42:β40 испод 0,89) дијагностикован према Мекхановим критеријумима, са резултатима Мини-психијатријског прегледа (MMSE) од 18 до 26, резултатима на скали геријатријске депресије (GDS) испод 5,0, резултатима на модификованој Хачинској скали исхемијске депресије (HIS) ≤ 4,0, формалним образовањем ≥ 8 година и претходним когнитивним падом ≥ 6 месеци.
Учесници који су испуњавали услове су узимали инхибиторе ацетилхолинестеразе (AChEI) или парцијалне антагонисте NMDA рецептора ≥ 3 месеца пре укључивања у студију. Нису узимали илегалне дроге као што су антипсихотици, бензодиазепини, антиепилептици, седативи, централно активни антихипертензиви, ноотропици (осим гинка билобе) или аналгетици који садрже опиоиде.
Примарни исход студије био је безбедност и подношљивост, процењене коришћењем Колумбија скале за процену тежине суицидалних мисли и понашања (C-SSRS), витални знаци, крвни притисак и хематолошки параметри. За процену секундарних когнитивних исхода коришћени су структурна магнетна резонанца (cMRI), флуородезоксиглукозна позитронска емисиона томографија (FDG-PET) и биомаркери цереброспиналне течности (CSF). Мере Алцхајмерове болести укључивале су Thr181-фосфориловани тау, укупни тау протеин, Aβ40, Aβ42 и активност AChE. Тим је користио прилагођени неуропсихолошки тест за процену секундарних когнитивних исхода на почетку, у 12. и 26. недељи.
Резултати истраживања
Студија је показала да је LM11A-31 безбедан и добро се подноси, без значајних безбедносних проблема. Најчешћи нежељени ефекти укључивали су главобољу, дијареју, еозинофилију и назофарингитис, при чему су гастроинтестинални проблеми и еозинофилија били главни разлози за прекид лечења. Било је више прекида лечења у групи са 400 мг у поређењу са групама са 200 мг и плацебом. МРИ није открила безбедносне проблеме, укључујући абнормалности повезане са амилоидом. Није било значајних разлика у когнитивним резултатима или амилоидним абнормалностима између две групе лечења.
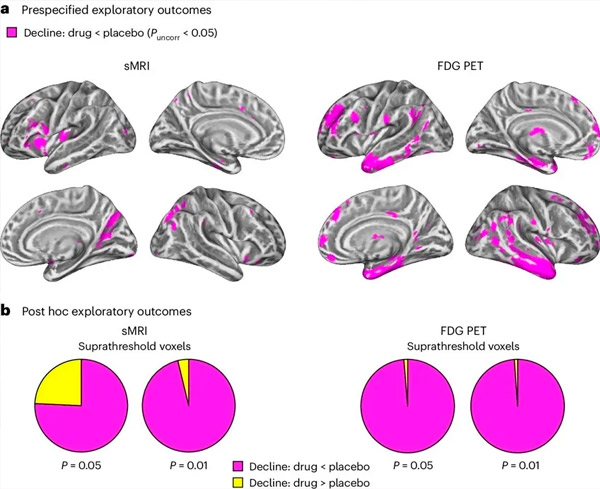
А. Двосмерна анализа коваријансе мешовитих модела испитивала је интеракције између третмана (лек или плацебо) и времена (пре или после третмана). Једнострани t-контраст који испитује хипотезу о интеракцији (лек успорава прогресију у поређењу са плацебом) показао је да је третман LM11A-31 успорио лонгитудиналну дегенерацију (леви панели) и хипометаболизам глукозе (десни панели) у групи која је примала лек (cMRI, n = 127; PET, n = 121) у поређењу са плацебо групом (cMRI, n = 66; PET, n = 62). Воксели који показују ову интеракцију приказани су на некоригованом прагу од P < 0,05 (магента) на популационо специфичној кортикалној површини. Лева и десна хемисфера су приказане у горњем и доњем реду, респективно. Региони мозга који показују интеракције које нису у складу са хипотезом приказани су на слици 7 у Додатним подацима.
Б. Укупан број воксела у унапред дефинисаним рањивим регионима мозга за Алцхајмерову болест (укупна површина кружних дијаграма) који показују или интеракцију у складу са хипотезом (магента) или интеракцију која није у складу са хипотезом (жута) у свакој модалитету снимања (цМРИ, леви панел; ФДГ ПЕТ, десни панел) при све либералнијим праговима некориговане P < 0,01 и P < 0,05. Монте Карло симулације су показале да су односи воксела који показују ефекте у складу са хипотезом наспрам оних који нису у складу са хипотезом значајно већи од оних примећених на основу насумично генерисаних података и за цМРИ и за ПЕТ (P < 0,001 за сваку модалитет; двострани тест).
LM11A-31 је ефикасно смањио повећање Aβ42 и Aβ40 у цереброспиналној течности у поређењу са плацебо групом. Лек је такође показао смањење средње годишње процентуалне промене пресинаптичког протеинског биомаркера SNAP25 и смањење постсинаптичког биомаркера NG, што указује на успоравање губитка пресинаптичких и постсинаптичких веза. LM11A-31 је такође смањио повећање YKL40, што је довело до смањења MMSE резултата и повећања ADAS-Cog-13 резултата. Лек је такође смањио губитак сиве масе у фронталном режњу и задњем паријеталном кортексу и смањење метаболизма глукозе у областима као што су енторинални кортекс, темпорални кортекс, хипокампус, инсуларни кортекс и префронтални кортекс.
Закључак
Студија је закључила да је модулација p75NTR помоћу LM11A-31 погодна за већа клиничка испитивања. LM11A-31 је испунио примарни циљ безбедности и добро је толерисан код пацијената са благом до тешком Алцхајмеровом болешћу. Резултати указују на потребу за даљим студијама са дужим трајањем лечења како би се проценио потенцијал малих молекула да регулишу p75NTR као терапију која модификује ток болести код Алцхајмерове болести. Студија је показала да LM11A-31 значајно утиче на неколико биомаркера, укључујући Aβ40, Aβ42, SNAP25, NG и YKL40, што указује на успоравање патолошке прогресије. Будуће студије могу проценити додатне индикаторе здравља глијалних ћелија.
