
Сви иЛиве садржаји су медицински прегледани или проверени како би се осигурала што већа тачност.
Имамо стриктне смјернице за набавку и само линкамо на угледне медијске странице, академске истраживачке институције и, кад год је то могуће, медицински прегледане студије. Имајте на уму да су бројеви у заградама ([1], [2], итд.) Везе које се могу кликнути на ове студије.
Ако сматрате да је било који од наших садржаја нетачан, застарио или на неки други начин упитан, одаберите га и притисните Цтрл + Ентер.
Кључни протеин идентификован за спречавање губитка коштане масе код остеопорозе
Последње прегледано: 02.07.2025
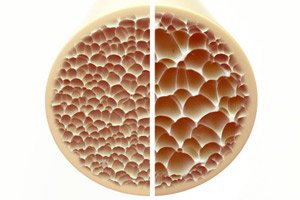
Остеопороза, стање које карактеришу порозне и крхке кости, представља значајну претњу по здравље скелета. Кости, као примарни структурни ослонац људског тела, пружају виталну потпору. Када се коштана маса смањи, то не само да нарушава ову потпору, већ и нарушава целокупну функцију, што доводи до смањеног квалитета живота.
Како се учесталост остеопорозе повећава код старије популације, расте и оптерећење здравствених ресурса за дугорочну негу. Стога је неопходно разумети механизме који доприносе развоју остеопорозе и развити ефикасне циљане третмане како би се минимизирао њен дугорочни утицај.
Остеобласти и остеокласти су две врсте ћелија које играју кључну улогу у одржавању и ремоделирању коштаног ткива. Док су остеобласти ћелије које формирају кост и одговорне су за синтезу и таложење новог коштаног ткива, остеокласти су ћелије које разграђују кости и учествују у разградњи и уклањању старог или оштећеног коштаног ткива.
Повећање удела остеокласта доводи до губитка коштане масе у стањима као што су остеопороза, реуматоидни артритис (упала зглобова) и коштане метастазе (рак који се проширио на кости). Остеокласти настају диференцијацијом макрофага или моноцита, који су врсте имуних ћелија.
Стога, инхибиција диференцијације остеокласта може послужити као терапијска стратегија за спречавање губитка коштане масе. Међутим, прецизни молекуларни механизми који регулишу сложени процес ремоделирања костију остају нејасни.
У новој студији, професор Тадајоши Хајата, г. Такуто Коно и гђа Хитоми Мурачи са Универзитета науке у Токију, заједно са колегама, истражили су молекуларну регулацију диференцијације остеокласта. Стимулација лигандом рецептора активатора нуклеарног фактора капа Б (RANKL) индукује диференцијацију макрофага у остеокласте.
Поред тога, сигнални путеви коштаног морфогенетског протеина (BMP) и трансформишућег фактора раста (TGF)-β су имплицирани у регулацију RANKL-посредоване диференцијације остеокласта. У тренутној студији, истраживачи су имали за циљ да истраже улогу Ctdnep1, фосфатазе (ензима који уклања фосфатне групе) за коју је објављено да сузбија сигналне путеве BMP и TGF-β.
Студија је објављена у часопису „Biochemical and Biophysical Research Communications“.
Професор Хајата наводи: „RANKL делује као 'акцелератор' за диференцијацију остеокласта. Вожња аутомобила захтева не само гас већ и кочнице. Овде смо открили да Ctdnep1 делује као 'кочница' у диференцијацији остеокласта.“
Истраживачи су прво испитали експресију Ctdnep1 у мишјим макрофагима третираним RANKL-ом и нетретираним контролним ћелијама. Приметили су да се експресија Ctdnep1 није променила као одговор на стимулацију RANKL-ом. Међутим, био је локализован у цитоплазми у грануларном облику у макрофагима и диференциран у остеокласте, за разлику од његове нормалне перинуклеарне локализације у другим типовима ћелија, што указује на његову цитоплазматску функцију у диференцијацији остеокласта.
Штавише, смањење експресије Ctdnep1 (снижавање експресије гена) резултирало је повећањем броја остеокласта позитивних на тартарат-резистентну киселу фосфатазу (TRAP), где је TRAP маркер диференцираних остеокласта.
Нокаутирање Ctdnep1 је резултирало повећаном експресијом кључних маркера диференцијације, укључујући „Nfatc1“, главни транскрипциони фактор индукован RANKL-ом за диференцијацију остеокласта. Ови резултати подржавају „кочиону функцију“ Ctdnep1, при чему он негативно регулише диференцијацију остеокласта. Штавише, нокаутирање Ctdnep1 је такође резултирало повећаном апсорпцијом калцијум фосфата, што указује на супресивну улогу Ctdnep1 у ресорпцији костију.
Коначно, иако нокаут Ctdnep1 није променио BMP и TGF-β сигнализацију, ћелије са недостатком Ctdnep1 показале су повећане нивое фосфорилисаних (активираних) протеина, који су производи RANKL сигналног пута. Ови резултати указују на то да инхибиторни ефекат Ctdnep1 на диференцијацију остеокласта можда није посредован BMP и TGF-β сигнализацијом, већ смањењем RANKL сигналног пута и нивоа Nfatc1 протеина.
Генерално, ови резултати пружају нове увиде у процес диференцијације остеокласта и идентификују потенцијалне терапијске циљеве који би се могли користити за развој третмана за смањење губитка коштане масе услед прекомерне активности остеокласта. Поред болести које карактерише губитак коштане масе, Ctdnep1 је такође идентификован као узрочни фактор медулобластома, тумора мозга у детињству. Аутори су оптимистични да се њихово истраживање може проширити на друге људске болести изван метаболизма костију.
Професор Хајата закључује: „Наши резултати указују на то да је Ctdnep1 неопходан за спречавање прекомерне остеокластогенезе. Ови резултати могу додатно проширити наше знање о томе како мрежа фосфорилације-дефосфорилације контролише диференцијацију остеокласта и могу пружити нове терапијске стратегије за лечење коштаних болести повезаних са прекомерном активношћу остеокласта.“
