
Сви иЛиве садржаји су медицински прегледани или проверени како би се осигурала што већа тачност.
Имамо стриктне смјернице за набавку и само линкамо на угледне медијске странице, академске истраживачке институције и, кад год је то могуће, медицински прегледане студије. Имајте на уму да су бројеви у заградама ([1], [2], итд.) Везе које се могу кликнути на ове студије.
Ако сматрате да је било који од наших садржаја нетачан, застарио или на неки други начин упитан, одаберите га и притисните Цтрл + Ентер.
Идентификован протеин одговоран за генетске инфламаторне болести
Последње прегледано: 02.07.2025
Тим истраживача предвођен др Хироцугуом Одом из CECAD кластера изврсности за истраживање старења на Универзитету у Келну открио је улогу коју одређени протеински комплекс игра у неким облицима имунолошке дисрегулације. Овај резултат може довести до развоја нових терапијских приступа усмерених на смањење аутоинфлације и „обнављање“ имуног система пацијената који пате од генетске дисфункције овог протеинског комплекса.
Студија под називом „Бијалелни губитак функције људског SHARPIN-а изазива аутоинфламацију и имунодефицијенцију“ објављена је у часопису Nature Immunology.
Линеарни убиквитин-склапајући комплекс (LUBAC), састављен од протеина HOIP, HOIL-1 и SHARPIN, одавно је препознат по својој кључној улози у одржавању имунолошке хомеостазе. Претходне студије на мишевима показале су тешке последице губитка SHARPIN-а, што доводи до тешког дерматитиса услед прекомерне смрти ћелија коже. Међутим, специфичне здравствене последице недостатка SHARPIN-а код људи остале су нејасне.
Истраживачки тим је први пут пријавио две особе са недостатком SHARPIN-а које показују симптоме аутоинфлације и имунодефицијенције, али неочекивано не показују дерматолошке проблеме као што су то чинили мишеви.
Даљим испитивањем, утврђено је да ове особе имају оштећен канонски NF-κB одговор, важан пут имуног одговора. Такође су имале повећану подложност ћелијској смрти изазваној члановима суперфамилије фактора некрозе тумора (TNF). Лечење једног пацијента са недостатком SHARPIN-а анти-TNF терапијом, која специфично инхибира ћелијску смрт изазвану TNF-ом, резултирало је потпуним решавањем аутоинфлације на ћелијском нивоу и у клиничкој презентацији.
Студија показује да прекомерна и неконтролисана ћелијска смрт игра кључну улогу у генетским људским инфламаторним болестима. Один тим је додао недостатак SHARPIN-а као новог члана групе генетских људских инфламаторних болести које предлажу да назову „урођене грешке ћелијске смрти“.
Заштита од имунолошке дисрегулације Студија је започета у лабораторији др Дена Кастнера у Националним институтима за здравље (NIH) у Сједињеним Државама. Научници су тамо имали прилику да посматрају једног пацијента са необјашњивим епизодама грознице, артритиса, колитиса и имунодефицијенције које су се појавиле у детињству.
Након добијања информисаног пристанка, извршили су секвенцирање егзома код пацијента и чланова његове породице и открили да пацијент има разарајућу генетску варијанту у гену SHARPIN која је довела до немерљивих нивоа протеина SHARPIN. Такође су открили да ћелије пацијента показују повећану склоност ка умирању и у култивисаним ћелијама и у биопсијама пацијента.
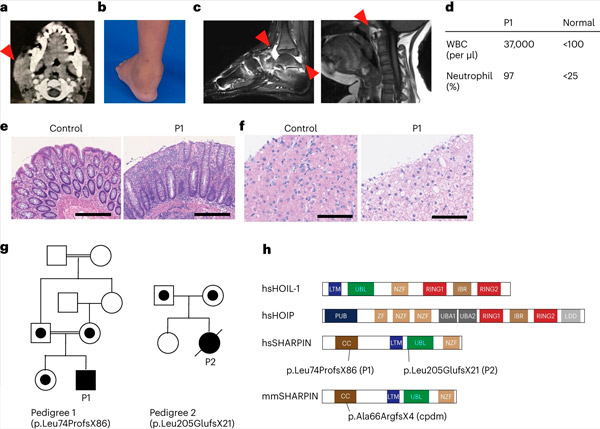
Недостатак SHARPIN-а код људи изазива аутоинфламацију и гликогенозу јетре. Извор: Nature Immunology (2024). DOI: 10.1038/s41590-024-01817-w
Тим је такође открио да је развој лимфоидних герминативних центара – специјализованих микроструктура у аденоидима које су кључне за сазревање Б ћелија нашег имуног система и, самим тим, за производњу антитела – значајно смањен због повећане смрти Б ћелија. Ови налази објашњавају имунодефицијенцију пацијената и истичу важну улогу LUBAC-а у одржавању имунолошке хомеостазе код људи.
„Наша студија истиче кључни значај LUBAC-а у заштити од имунолошке дисрегулације. Разјашњавањем молекуларних механизама који леже у основи недостатка LUBAC-а, отварамо пут новим терапијским стратегијама усмереним на обнављање имунолошке хомеостазе“, рекао је Ода, главни аутор студије.
Додао је: „Један од пацијената са недостатком SHARPIN-а био је годинама везан за инвалидска колица пре него што смо га први пут видели. Његови чланци су били упаљени и било је превише болно ходати. Генетска дијагноза нам је омогућила да циљамо исправан молекуларни пут који је у основи његовог стања.“
Од када је пацијент почео да прима анти-ТНФ терапију, он је без симптома скоро седам година. „Као клиничар и научник, драго ми је што имам прилику да позитивно утичем на живот једног пацијента кроз наше истраживање“, закључио је Ода.
