
Сви иЛиве садржаји су медицински прегледани или проверени како би се осигурала што већа тачност.
Имамо стриктне смјернице за набавку и само линкамо на угледне медијске странице, академске истраживачке институције и, кад год је то могуће, медицински прегледане студије. Имајте на уму да су бројеви у заградама ([1], [2], итд.) Везе које се могу кликнути на ове студије.
Ако сматрате да је било који од наших садржаја нетачан, застарио или на неки други начин упитан, одаберите га и притисните Цтрл + Ентер.
Рестеноза
Медицински стручњак за чланак
Последње прегледано: 04.07.2025
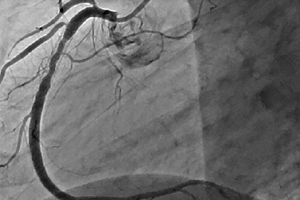
Рестеноза је развој рекурентног сужења од 50% или више на месту перкутане коронарне интервенције. Рестеноза је обично праћена рекурентном ангином, која често захтева поновљене интервенције. Како се перкутана коронарна интервенција развијала, учесталост рестенозе се смањивала, а и њена природа се такође променила.
Рестеноза након транслуминалне балонске коронарне ангиопластике (ТБКА)
Након ТБКА, стопа рестенозе у првих 6 месеци је 30-40%. Главни механизам њеног развоја је локално негативно ремоделирање крвног суда, што је, у суштини, еластични колапс артеријског лумена, проширеног балоном током процедуре. Локално формирање тромба и раст неоинтиме такође играју релативну улогу. Постоје клинички (дијабетес мелитус типа 2, акутни коронарни синдром (АКС), историја рестенозе), ангиографски (лезија ЛАД-а, мали пречник крвног суда, хронична тотална оклузија (ХТО), дуга лезија, дегенерисани венски бајпас графтови) и процедурални (велика резидуална стеноза, мало повећање пречника крвног суда као резултат надувавања балона) фактори ризика за рестенозу након ТБКА. У случају рестенозе, обично се изводи поновљена интервенција. Успех поновљене ТБКА на месту рестенозе је упоредив са првим поступком. Међутим, са сваком следећом ТБКА за рестенозу, ризик од рекурентне рестенозе значајно се повећава. Након 3. покушаја достиже 50-53%. Поред тога, са сваком поновљеном ТБЦА, рестеноза у развоју је израженија од прве. Фактори ризика за рестенозу након друге ТБЦА за рестенозу су рана појава прве рестенозе (60-90 дана након процедуре), оштећење ЛАД-а, оштећење више крвних судова, дијабетес мелитус типа 2, артеријска хипертензија, нестабилна ангина и вишеструке балонске инфлације током прве процедуре. С обзиром на високу учесталост рестенозе и механизам њеног развоја, у клиничку праксу су уведени коронарни стентови, који су теоретски требало да елиминишу негативно ремоделирање крвних судова након ТБЦА.
Прве студије које су показале ефикасност стентирања биле су студије STRESS и BENESTENT објављене 1993. године. BENESTENT је обухватио 516 пацијената са новодијагностикованом стенозом коронарних артерија пречника већег од 3 мм, који су рандомизовани у две групе: конвенционална ТБЦА (n = 257) и ТБЦА са постављањем стента (n = 259). Након 3 године, стопа рестенозе током ангиографије била је 32% у групи са конвенционалном ТБЦА и 22% у групи са стентирањем. Релативно смањење стопе рестенозе било је 31% (p < 0,01). Група са стентирањем је такође имала мању потребу за поновљеном реваскуларизацијом миокарда (10 наспрам 20,6% у групи са конвенционалном ТБЦА; p < 0,01), што је било повезано са мањом стопом рецидива ангине у групи са стентирањем.
Према STRESS студији (n = 407), стопа рестенозе је такође била нижа у групи са стентирањем (n ~ 205) него у конвенционалној ПТКА групи (n = 202) - 31,6 наспрам 42,1% (p < 0,01). Предност коришћења стентова у односу на конвенционалну ангиопластику у случају рестенозе на месту ПТКА показана је у REST студији, у којој је 383 пацијента са рестенозом рандомизовано у групу са стентирањем или поновљену перкутану транслуминалну коронарну ангиопластику. Ангиографски откривена поновљена рестеноза била је 18% нижа у групи са стентирањем (18 наспрам 5,32%; p < 0,03). Поновљена реваскуларизација миокарда, која је индикатор клинички значајне рестенозе, такође је била потребна значајно ређе у групи пацијената који су подвргнути стентирању (10 наспрам 27%; p < 0,001). Дакле, бољи резултати уз употребу стента су доказани не само у нативним артеријама, већ и у случају интервенције због рестенозе која се развила након ТВКА.
Рестеноза након имплантације голог стента (BSI)
Иако су непокривени коронарни стентови смањили учесталост рестенозе за 30-40% у поређењу са ТБЦА, 17-32% пацијената развија рестенозу у стенту чак и након стентирања, што захтева поновљену реваскуларизацију. Механизам развоја стенозе у стенту (ИСС) разликује се од оног код ТБЦА. Након стентирања, главни допринос рестенози је формирање неоинтиме, а не негативно ремоделирање, као код ТБЦА, које је практично одсутно на месту имплантације стента. Неоинтима се формира миграцијом и пролиферацијом ћелија глатких мишића које производе екстрацелуларни матрикс, који заједно са ћелијама чини неоинтиму. Поред тога, перзистенција тромба на месту стентирања је такође важна код пацијената са дијабетесом.
Главна класификација стенозе у стенту (ISS) је класификација коју је предложио Мехран, а која обухвата четири типа у зависности од обима и тежине лезије: I тип ISS - локална (< 10 mm дужине), II тип - дифузна (> 10 mm дужине), III тип - пролиферативна (> 10 mm и протеже се изван стента) и IV тип - ISS која доводи до оклузије. Први тип је подељен на подтипове у зависности од локације у стенту: 1а - на кривини или између стентова, 1б - маргинална, 1ц - унутар стента, 1д - мултифокална.
Фактори ризика за развој ВРС су интервенције на венским бајпас графтовима, хроничне оклузије, остијалне лезије, мали пречник крвног суда, присуство резидуалне стенозе, стентирање за ВРС, мали пречник крвног суда након процедуре, ЛАД лезија, велика дужина стента, присуство дијабетеса, имплантација више стентова у једну лезију. Постоје индикације о утицају генетских фактора, посебно полиморфизма гена за гликопротеин IIIa и мутација гена за метилентетрахидрофолат редуктазу - гена који кодира интерлеукин-1. У случају развоја маргиналне рестенозе стента, главни фактор ризика је изражена атеросклеротска лезија у стентираном сегменту.
Рестеноза се јавља претежно током првих 6-8 месеци након перкутане коронарне интервенције. Већина пацијената развија клиничке симптоме приближно у исто време. ВРС се обично манифестује рекурентном ангином. Нестабилна ангина се јавља ређе (11-41% случајева). АИМ се развија код 1-6% пацијената. Дакле, најчешћи узрок ангине током периода од 1-6 месеци након стентирања је развој ВРС, који, по правилу, захтева поновљену реваскуларизацију. Постоји неколико метода за лечење ВРС. Може се извршити конвенционална ТБЦА, што доводи до даљег ширења стента (56% доприноса коначном повећању пречника крвног суда) и потискује неоинтиму кроз ћелије стента (44% доприноса коначном повећању пречника). Међутим, резидуална рестеноза се примећује у већини случајева на месту интервенције (у просеку 18%). Поред тога, након ТВКА, поновљена реваскуларизација је потребна у 11% случајева, чешће код пацијената са вишесудовном болешћу, ниском ЛВЕФ, у случају интервенција на венским бајпас графтовима или ране појаве првог ВРС. Ризик од развоја поновљеног ВРС након ТВКА такође зависи од врсте лезије и креће се од 10% у случају локалне рестенозе до 80% у случају интрастентне оклузије. Имплантација ЛЕС на месту ВРС не смањује ризик од његовог поновног појављивања у поређењу са само ТВКА.
Друга метода лечења ВРС је брахитерапија, која подразумева увођење радиоактивног извора у лумен коронарне артерије, спречавајући пролиферацију глатких мишићних ћелија и, сходно томе, смањујући ризик од рестенозе. Међутим, висока цена опреме, техничка сложеност поступка и повећана инциденца касне тромбозе стента (ЛТ) готово су потпуно искључили брахитерапију из клиничке употребе.
Револуционаран тренутак у лечењу ВРС-а било је увођење стентова који испуштају лекове. У поређењу са ЛЕС-ом у нативним артеријама, они смањују ризик од ВРС-а за 70-80%. Први подаци о ефикасности ДЕС-а код пацијената са већ развијеним ВРС-ом добијени су у регистру пацијената TAXUS III, у којем је, при коришћењу СПГ1 код таквих пацијената, учесталост рецидива ВРС-а била само 16% након 6 месеци, што је ниже него у претходно поменутим студијама са ТБЦА. У регистру TRUE, који је обухватио пацијенте након имплантације СЕС-а за рестенозу ЛЕС-а, након 9 месеци, поновна реваскуларизација је била потребна код мање од 5% пацијената, углавном са дијабетес мелитусом и АКС-ом. Студија TROPICAL је упоредила учесталост поновљене рестенозе код пацијената након имплантације ДЕС-а на месту рестенозе са подацима студија GAMMA I и GAMMA II, у којима је брахитерапија коришћена као метода лечења. После 6 месеци, инциденца рекурентне рестенозе била је значајно нижа у SPS групи (9,7 наспрам 40,3%; p < 0,0001). Важно је напоменути да је инциденца тромбозе стента и инфаркта миокарда такође била нижа у SPS групи (TS 0,6 наспрам 3,9%; p = 0,08; MI - 1,8 наспрам 9,4%; p = 0,004). Предност SPS у односу на брахитерапију потврђена је у рандомизованој SISR студији, у којој је 384 пацијента са развијеним VRS у NSC рандомизовано у групе са брахитерапијом или SPS имплантацијом. После 9 месеци, потреба за поновном реваскуларизацијом била је већа након брахитерапије (19,2%) него у групи са SPS имплантацијом (8,5%), што је одражавало чешћу рецидив рестенозе. После 3 године, предност SPS у смислу смањења потребе за поновном реваскуларизацијом због рекурентне рестенозе стента је остала (19 наспрам 28,4%). Није било значајне разлике у учесталости тромбозе између група.
Главни фактори за развој рекурентне ВРС код пацијената са ЛЕС у случају имплантације СПС-а су мали пречник крвног суда (< 2,5 мм), дифузни тип рестенозе и присуство хроничне бубрежне инсуфицијенције која захтева хемодијализу. У рандомизованој студији TAXUS V ISR, СПС је такође показао високу ефикасност у лечењу ВРС-а, смањујући стопу рекурентне рестенозе за 54% у поређењу са брахитерапијом.
Такође су спроведена рандомизована испитивања која су упоређивала ефикасност TBCA за имплантацију VRS и DES. У рандомизованом RIBS-II испитивању, након 9 месеци, поновљена рестеноза је била 72% ређа након имплантације DES него након TBCA, што је смањило потребу за поновљеном реваскуларизацијом са 30 на 11%. ISAR DESIRE испитивање је упоредило ефикасност TBCA за VRS са имплантацијом SPP или SPS. Након 6 месеци, испоставило се да су оба DES била ефикаснија у спречавању поновљене рестенозе од TBCA (њена инциденца је била 44,6% са TBCA, 14,3% у SPS групи и 21,7% у SPS групи), што је смањило потребу за поновљеном реваскуларизацијом. У директном поређењу SPP и SPS, утврђено је да SPS значајно ефикасније смањује потребу за поновљеном реваскуларизацијом од SPP (8 наспрам 19%). Дакле, имплантација DES смањује инциденцу рекурентних LES VRS у поређењу са TBCA и брахитерапијом, што смањује број поновљених PCI и стога чини њихову имплантацију процедуром избора код таквих пацијената.
Рестеноза након имплантације стента који испушта лекове (DES)
Упркос смањењу учесталости стенозе у стенту за 70-80% при коришћењу ДЕС у поређењу са ЛЕС, нису могли у потпуности искључити развој ове јатрогене последице стентирања. Њена укупна учесталост остаје у просеку мања од 10%. Поред квантитативног смањења учесталости рестенозе, значајно су променили и врсту рестенозе која се јавља. Дакле, након имплантације ДЕС, рестеноза је обично фокална. Клинички, као и у случају ЛЕС, најчешће се манифестује као рецидив стабилне ангине (77%), ређе (8%) је асимптоматска. У 5% случајева, манифестује се као нестабилна ангина, а у 10%, њен први симптом је инфаркт миокарда без Q таласа. Главни фактори у развоју рестенозе ДЕС су дијабетес мелитус типа 2, мали пречник крвног суда и обим лезије. Не постоје јасне препоруке за лечење таквих пацијената. Алтернативне опције су реимплантација ДЕС-а (истог или другог типа), ТВКА или брахитерапија. Просечна стопа ререстенозе са другим ДЕС-ом је 24%, и иста је без обзира да ли се имплантира исти тип ДЕС-а или други.


 [
[