
Сви иЛиве садржаји су медицински прегледани или проверени како би се осигурала што већа тачност.
Имамо стриктне смјернице за набавку и само линкамо на угледне медијске странице, академске истраживачке институције и, кад год је то могуће, медицински прегледане студије. Имајте на уму да су бројеви у заградама ([1], [2], итд.) Везе које се могу кликнути на ове студије.
Ако сматрате да је било који од наших садржаја нетачан, застарио или на неки други начин упитан, одаберите га и притисните Цтрл + Ентер.
Патогенеза хепатитиса Б
Медицински стручњак за чланак
Последње прегледано: 07.07.2025
У патогенези хепатитиса Б може се идентификовати неколико водећих карика у патогенетском ланцу:
- уношење патогена - инфекција;
- фиксација на хепатоцит и продирање у ћелију;
- умножавање вируса и његово „истискивање“ на површину хепатоцита, као и у крв;
- активација имунолошких реакција усмерених на елиминацију патогена;
- оштећење органа и система имуним комплексима;
- формирање имунитета, ослобађање од патогена, опоравак.
Пошто се инфекција хепатитисом Б увек дешава парентерално, може се сматрати да је тренутак инфекције практично еквивалентан продору вируса у крв. Покушаји неких истраживача да разликују ентералну и регионалну фазу код хепатитиса Б слабо су поткрепљени. Постоји више основа за веровање да вирус одмах улази у јетру са током крви.
Тропизам вируса хепатитиса Б према ткиву јетре је предодређен присуством посебног рецептора у HBsAg - полипептида молекулске тежине од 31.000 Da (P31), који има активност везивања албумина. Слична албуминска зона се налази и на мембрани хепатоцита у јетри људи и шимпанзи, што у суштини одређује тропизам HBV према јетри људи и шимпанзи.
Када вирус продре у хепатоцит, ослобађа се вирусна ДНК која, улазећи у једро хепатоцита и делујући као матрица за синтезу нуклеинских киселина, покреће низ секвенцијалних биолошких реакција, чији је резултат склапање нуклеокапсида вируса. Нуклеокапсид мигрира кроз нуклеарну мембрану у цитоплазму, где се дешава коначно склапање Дејнових честица - комплетног вируса хепатитиса Б.
Треба, међутим, напоменути да када је хепатоцит инфициран, процес може да се одвија на два начина - репликативно и интегративно. У првом случају се развија слика акутног или хроничног хепатитиса, а у другом - вирусно ношење.
Разлози који одређују два типа интеракције између вирусне ДНК и хепатоцита нису прецизно утврђени. Највероватније је тип одговора генетски одређен.
Резултат репликативне интеракције је склапање основних антигенских структура (у једру) и склапање комплетног вируса (у цитоплазми), након чега следи презентација комплетног вируса или његових антигена на мембрани или у структури мембране хепатоцита.
Општеприхваћено је да репликација вируса не доводи до оштећења ћелија на нивоу хепатоцита, будући да вирус хепатитиса Б нема цитопатски ефекат. Овај став се не може сматрати неспорним, јер се заснива на експерименталним подацима који, иако указују на одсуство цитопатског ефекта вируса хепатитиса Б, добијени су на културама ткива и стога се не могу у потпуности екстраполирати на вирусни хепатитис Б код људи. У сваком случају, питање одсуства оштећења хепатоцита током репликативне фазе захтева додатна истраживања.
Међутим, без обзира на природу интеракције вируса са ћелијом, јетра је нужно укључена у имунопатолошки процес. У овом случају, оштећење хепатоцита повезано је са чињеницом да се као резултат експресије вирусних антигена на мембрани хепатоцита и ослобађања вирусних антигена у слободну циркулацију укључује ланац секвенцијалних ћелијских и хуморалних имуних реакција, чији је крајњи циљ уклањање вируса из организма. Овај процес се одвија у потпуности у складу са општим обрасцима имуног одговора на вирусне инфекције. Да би се елиминисао патоген, укључују се ћелијске цитотоксичне реакције, посредоване различитим класама ефекторских ћелија: К ћелијама, Т ћелијама, природним убицама, макрофагима. Током ових реакција, инфицирани хепатоцити се уништавају, што је праћено ослобађањем вирусних антигена (HBcAg, HBeAg, HBsAg), који покрећу систем генезе антитела, услед чега се специфична антитела акумулирају у крви, првенствено на језгро - анти-HBc и е-антиген - анти-HBE. Сходно томе, ослобађање ћелије јетре од вируса се дешава у процесу њене смрти услед реакција ћелијске цитолизе.
Истовремено, специфична антитела која се акумулирају у крви везују антигене вируса, формирајући имуне комплексе које фагоцитују макрофаги и излучују бубрези. У овом случају могу се јавити различите лезије имуних комплекса у облику гломерулонефритиса, артеритиса, артралгије, кожних осипа итд. Уз учешће специфичних антитела, тело се чисти од патогена и долази до потпуног опоравка.
У складу са изложеном концепцијом патогенезе хепатитиса Б, сва разноликост клиничких варијанти тока болести обично се објашњава особеностима интеракције вируса и сарадњом имунокомпетентних ћелија, другим речима, снагом имуног одговора на присуство вирусних антигена. Према савременим концептима, снага имуног одговора је генетски одређена и повезана са антигенима хистокомпатибилности HLA локуса прве класе.
Општеприхваћено је да се под условима адекватног имуног одговора на вирусне антигене, акутни хепатитис клинички развија са цикличним током и потпуним опоравком. На позадини смањења имуног одговора на вирусне антигене, имуно-посредована цитолиза је изражена незнатно, стога не долази до ефикасног елиминисања инфицираних ћелија јетре, што доводи до благих клиничких манифестација са дуготрајном перзистенцијом вируса и, могуће, развојем хроничног хепатитиса. Истовремено, напротив, у случају генетски детерминисаног снажног имуног одговора и масивне инфекције (хемотрансфузија), настају опсежна подручја оштећења ћелија јетре, која клинички одговарају тешким и малигним облицима болести.
Представљена шема патогенезе хепатитиса Б одликује се својом кохерентношћу; међутим, садржи низ контроверзних и слабо проучених тачака.
Ако пратимо концепт хепатитиса Б као имунопатолошке болести, могли бисмо очекивати повећање ћелијских цитотоксичних реакција са повећањем тежине болести. Међутим, код тешких облика, индекси ћелијског имунитета су нагло смањени, укључујући вишеструки пад, у поређењу са здравом децом, и индекс цитотоксичности К-ћелија. У малигном облику, током периода развоја масивне некрозе јетре и посебно хепатичне коме, примећује се потпуна неспособност лимфоцита за бластну трансформацију под утицајем фитохематутинина, стафилококног ендотоксина и HBsAg. Поред тога, не постоји способност леукоцита да мигрирају према реакцији инхибиције миграције леукоцита (LMIC), а откривено је нагло повећање пропустљивости лимфоцитних мембрана према резултатима њихових студија коришћењем флуоресцентне тетрациклинске сонде.
Дакле, ако су индекси флуоресценције лимфоцита код здравих особа 9,9±2%, а код типичног хепатитиса Б са бенигним током повећавају се на 22,3±2,7%, онда код малигних облика број флуоресцентних лимфоцита достиже просечно 63,5±5,8%. Пошто се повећање пропустљивости ћелијских мембрана у литератури недвосмислено оцењује као поуздан показатељ њихове функционалне инфериорности, може се закључити да код хепатитиса Б, посебно у малигном облику, долази до грубог оштећења лимфоцита. О томе сведоче и индекси цитотоксичности К-ћелија. У тешком облику, у 1-2. недељи болести, цитотоксичност је 15,5±8,8%, а у малигном облику у 1. недељи - 6,0±2,6, у 2. недељи - 22,0±6,3% са нормом од 44,8±2,6%.
Приказани подаци јасно указују на изражене поремећаје у ћелијској вези имунитета код пацијената са тешким облицима хепатитиса Б. Такође је очигледно да се ове промене јављају секундарно, као резултат оштећења имунокомпетентних ћелија токсичним метаболитима и, могуће, циркулишућим имуним комплексима.
Како су студије показале, код пацијената са тешким облицима хепатитиса Б, посебно у случају развоја масивне некрозе јетре, титар HBsAg и HBeAg у крвном серуму се смањује и истовремено почињу да се детектују антитела на површински антиген у високим титрима, што је потпуно некарактеристично за бенигне облике болести, код којих се анти-HBV јављају тек у 3-5 месеци болести.
Брзи нестанак антигена вируса хепатитиса Б уз истовремену појаву високих титара антивирусних антитела сугерише интензивно формирање имуних комплекса и њихово могуће учешће у патогенези развоја масивне некрозе јетре.
Дакле, чињенични материјали нам не дозвољавају да недвосмислено тумачимо хепатитис Б само са становишта имунопатолошке агресије. И поента није само у томе што није пронађена веза између дубине и преваленције морфолошких промена у јетри, с једне стране, и тежине фактора ћелијског имунитета, с друге стране. Теоретски, ова околност би се могла објаснити касним фазама проучавања индикатора ћелијског имунитета, када су имунокомпетентне ћелије биле изложене снажним токсичним ефектима услед повећане функционалне инсуфицијенције јетре. Наравно, може се претпоставити да се имунска цитолиза хепатоцита јавља у најранијим фазама инфективног процеса, могуће чак и пре појаве клиничких симптома тешког оштећења јетре. Међутим, таква претпоставка је мало вероватна, јер су слични индикатори ћелијског имунитета откривени код пацијената са најакутнијим (муњевитим) током болести и, поред тога, током морфолошког прегледа ткива јетре није откривена масивна лимфоцитна инфилтрација, док су истовремено откривена континуирана поља некротичног епитела без феномена ресорпције и лимфоцитне агресије.
Веома је тешко објаснити морфолошку слику акутног хепатитиса само са становишта имунолошке ћелијске цитолизе, стога у раним студијама цитотоксични ефекат вируса хепатитиса Б није био искључен.
Тренутно је ова претпоставка делимично потврђена открићем вируса хепатитиса Б. Како су студије показале, учесталост детекције маркера хепатитиса Д директно зависи од тежине болести: код благих облика, они се детектују код 14%, умерених - код 18%, тешких - 30%, а малигних - код 52% пацијената. С обзиром на то да вирус хепатитиса Д има некрозогени цитопатски ефекат, може се сматрати утврђеним да је коинфекција са вирусима хепатитиса Б и Д од великог значаја у развоју фулминантних облика хепатитиса Б.
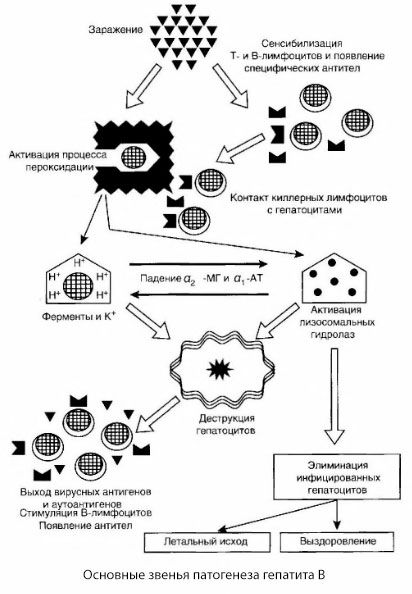
Патогенеза хепатитиса Б може се представити на следећи начин. Након продора вируса хепатитиса Б у хепатоците, имунолошки напад на заражене хепатоците изазивају Т-убице, које луче лимфотоксине у правцу ћелија јетре.
Детаљни механизми оштећења хепатоцита код хепатитиса Б још увек нису утврђени. Водећу улогу играју активирани процеси липидне пероксидације и лизозомалних хидролаза. Окидач могу бити лимфотоксини који се ослобађају из ефекторских ћелија при њиховом контакту са хепатоцитима, али је могуће да сам вирус буде покретач процеса пероксидације. Након тога, патолошки процес се највероватније развија у следећем редоследу.
- Интеракција фактора агресије (лимфотоксина или вируса) са биолошким макромолекулима (могуће са компонентама мембрана ендоплазматског ретикулума способним да учествују у процесима детоксикације, по аналогији са другим штетним агенсима, као што је показано у вези са угљен-тетрахлоридом).
- Формирање слободних радикала, активација процеса липидне пероксидације и повећана пропустљивост свих хепатоцелуларних мембрана (синдром цитолизе).
- Кретање биолошки активних супстанци дуж градијента концентрације - губитак ензима различитих интрацелуларних локализација, донора енергије, калијума итд. Акумулација натријума и калцијума у ћелијама, померање pH вредности ка интрацелуларној ацидози.
- Активација и ослобађање лизозомалних хидролаза (РНКазе, ДНКазе, катепсина, итд.) са разградњом ћелија јетре и ослобађањем аутоантигена.
- Стимулација Т- и Б-имуног система са формирањем специфичне сензибилизације Т-лимфоцита на липопротеине јетре, као и формирање антихепатичних хуморалних аутоантитела.
У предложеној шеми патогенезе хепатитиса Б, фактор окидача су вирусни антигени, чија се интензивна производња примећује у најранијим фазама болести и током целог акутног периода, са изузетком малигних облика, код којих производња вирусних антигена практично престаје у тренутку развоја масивне некрозе јетре, што предодређује брзо смањење репликације вируса.
Такође је очигледно да вирусни антигени активирају Т- и Б-системе имунитета. Током овог процеса долази до карактеристичне прерасподеле субпопулација Т-лимфоцита, усмерене на организовање адекватног имуног одговора, елиминисање инфицираних хепатоцита, неутрализацију вирусних антигена, саногенезу и опоравак.
Када имунокомпетентне ћелије интерагују са вирусним антигенима на мембранама хепатоцита или током репродукције вируса унутар хепатоцита, настају услови за активацију процеса липидне пероксидације, која, као што је познато, контролише пропустљивост свих ћелијских и субћелијских мембрана.
Са ове позиције, појава синдрома цитолизе, повећане пропустљивости ћелијских мембрана, што је тако природно и веома карактеристично за вирусни хепатитис, постаје разумљива.
Коначни исход синдрома цитолизе може бити потпуно одвајање оксидативне фосфорилације, цурење ћелијског материјала и смрт паренхима јетре.
Међутим, у огромној већини случајева, ови процеси не стичу тако фаталан развој. Само код малигних облика болести патолошки процес се одвија лавинообразно и неповратно, пошто се јављају масивна инфекција, изражен имуни процес, прекомерна активација процеса пероксидације и лизозомских хидродаза, феномени аутоимуне агресије.
Исти механизми се примећују и код повољног тока хепатитиса Б, са једином особеношћу што се сви они реализују на квалитативно различитом нивоу. За разлику од случајева масивне некрозе јетре, код повољног тока болести број инфицираних хепатоцита, а самим тим и зона имунопатолошке цитолизе је мањи, процеси липидне пероксидације нису толико значајно појачани, активација киселих хидролаза доводи само до ограничене аутолизе са незнатним ослобађањем аутоантигена, и стога, без масивне аутоагресије, односно све фазе патогенезе код повољног тока се одвијају у оквиру очуване структурне организације паренхима јетре и обуздане су одбрамбеним системима (антиоксиданси, инхибитори итд.) и стога немају тако деструктивно дејство.
Узроци симптома интоксикације код вирусног хепатитиса нису у потпуности проучени. Предлог да се направи разлика између такозване примарне, или вирусне, интоксикације и секундарне (разменске, или метаболичке) може се сматрати позитивним, иако то не открива интимни механизам настанка општег токсичног синдрома. Прво, вируси хепатитиса немају токсична својства, а друго, концентрација многих метаболита не корелира увек са тежином болести и степеном изражености симптома токсикозе. Такође је познато да концентрација вирусних антигена не корелира стриктно са тежином интоксикације. Напротив, са повећањем тежине болести, а самим тим и повећањем степена токсикозе, концентрација HBsAg се смањује и најнижа је код малигних облика у време почетка дубоке хепатичне коме. Истовремено, учесталост детекције и титри специфичних антивирусних антитела директно зависе од тежине болести.
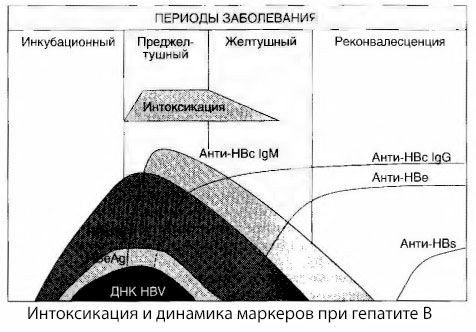
Интоксикација се не јавља у тренутку регистрације вирусних антигена, већ током периода циркулације у крви антивирусних антитела класе IgM на крављи антиген и антиген Е система. Штавише, код тешких, а посебно малигних облика, значајан део пацијената чак има анти-HBs у крви, што се обично никада не примећује код благих и умерених облика болести.
Приказани подаци нам омогућавају да закључимо да синдром токсикозе код вирусног хепатитиса, а посебно хепатитиса Б, не настаје као резултат појаве вирусних антигена у крви, већ је последица интеракције вирусних антигена са антивирусним антителима класе IgM. Резултат такве интеракције, као што је познато, је формирање имуних комплекса и, могуће, активних токсичних супстанци.
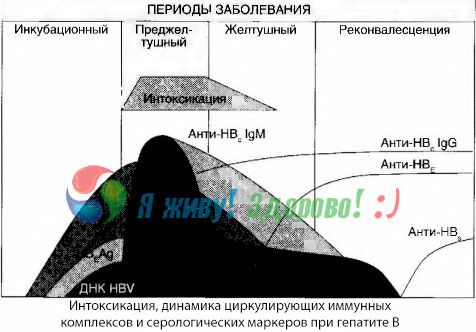
Симптоми интоксикације настају у тренутку појаве имуних комплекса у слободној циркулацији, али се накнадно таква корелација не примећује.
Делимично објашњење за ово може се наћи у проучавању састава имуних комплекса. Код пацијената са тешким облицима, у крви циркулишу претежно комплекси средње величине, а у њиховом саставу, на врхунцу токсичног синдрома, преовлађују антитела класе, док током периода опадања клиничких манифестација и реконвалесценције, комплекси постају већи, а у њиховом саставу почињу да преовлађују антитела класе IgG.
Приказани подаци се тичу механизама развоја токсичног синдрома у почетном периоду болести, али код токсикозе која се јавља на врхунцу клиничких манифестација, они имају само делимичан значај, а посебно код развоја хепатичне коме.
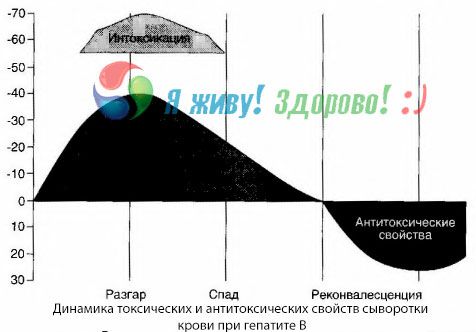
Метода хемокултуре је показала да се код хепатитиса Б токсини стално акумулирају у крви, ослобађајући се из оштећеног, распадајућег ткива јетре. Концентрација ових токсина је пропорционална тежини болести, протеинске су природе.
Током периода опоравка, антитела на овај токсин се појављују у крви; али у случају хепатичне коме, концентрација токсина у крви нагло расте, а антитела се не детектују у крви.
Патоморфологија хепатитиса Б
На основу природе морфолошких промена, разликују се три облика акутног хепатитиса Б:
- циклични облик,
- масивна некроза јетре;
- холестатски перихолангиолитички хепатитис.
Код цикличног облика хепатитиса Б, дистрофичне, инфламаторне и пролиферативне промене су израженије у центру лобула, док су код хепатитиса А локализоване дуж периферије лобула, ширећи се ка центру. Ове разлике се објашњавају различитим путевима продирања вируса у паренхим јетре. Вирус хепатитиса А улази у јетру кроз порталну вену и шири се до центра лобула, вирус хепатитиса Б продире кроз хепатичну артерију и капиларне гране које равномерно снабдевају све лобуле, све до њиховог центра.
Степен оштећења паренхима јетре у већини случајева одговара тежини клиничких манифестација болести. Код благих облика обично се примећује фокална некроза хепатоцита, а код умерених и тешких облика - зонална некроза (са тенденцијом спајања и формирања мостоликог некроза код тешких облика болести).
Највеће морфолошке промене у паренхиму се примећују на врхунцу клиничких манифестација, што се обично поклапа са првом деценијом болести. Током друге, а посебно треће деценије, процеси регенерације се интензивирају. До овог периода, некробиотичке промене скоро потпуно нестају и почињу да преовлађују процеси ћелијске инфилтрације са спорим накнадним обнављањем структуре хепатоцелуларних плоча. Међутим, потпуна рестаурација структуре и функције паренхима јетре јавља се тек 3-6 месеци након почетка болести и не код свих пацијената.
Генерализована природа инфекције код хепатитиса Б потврђује се детекцијом HBsAg не само у хепатоцитима, већ и у бубрезима, плућима, слезини, панкреасу, ћелијама коштане сржи итд.
Холестатски (перихолангиолитички) хепатитис је посебан облик болести, код којег се највеће морфолошке промене налазе на страни интрахепатичних жучних канала, са сликом холангиолитиса и перихолангиолитиса. У холестатском облику, холестаза се јавља са дилатацијом жучних капилара са стазом жучи у њима, са пролиферацијом холангиола и ћелијским инфилтратима око њих. Ћелије јетре су код овог облика хепатитиса незнатно погођене. Клинички, болест карактерише продужени ток са продуженом жутицом. Показано је да је узрок овако необичног тока болести претежно дејство вируса на зидове холангиола са незнатним дејством на хепатоците.

