
Сви иЛиве садржаји су медицински прегледани или проверени како би се осигурала што већа тачност.
Имамо стриктне смјернице за набавку и само линкамо на угледне медијске странице, академске истраживачке институције и, кад год је то могуће, медицински прегледане студије. Имајте на уму да су бројеви у заградама ([1], [2], итд.) Везе које се могу кликнути на ове студије.
Ако сматрате да је било који од наших садржаја нетачан, застарио или на неки други начин упитан, одаберите га и притисните Цтрл + Ентер.
Експериментални модели остеоартритиса
Медицински стручњак за чланак
Последње прегледано: 07.07.2025
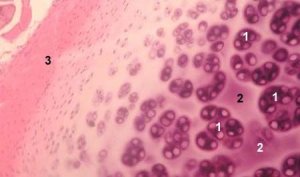
Хрскавица је високо специјализовано ткиво које садржи само једну врсту ћелија (хондроците) и карактерише се одсуством крвних и лимфних судова. Хрскавица се углавном храни апсорпцијом из синовијалне течности. Метаболизам хондроцита регулисан је бројним растворљивим факторима које локално производе хондроцити и околна ткива. Функција хондроцита такође зависи од састава екстрацелуларне средине (напон кисеоника, концентрација јона, pH, итд.), састава ванцелуларног матрикса, интеракције ћелија и матрикса и физичких сигнала. Главни циљ експерименталног моделирања је стварање култура у екстрацелуларној средини без промене фенотипа зрелих ћелија. Други циљ је стварање култура за проучавање превременог, одложеног, краткорочног или продуженог одговора хондроцита на хемијске и/или физичке сигнале. Студије ин витро такође пружају могућност за проучавање понашања хондроцита код остеоартрозе. Трећи циљ је развој система кокултуре који омогућавају проучавање интеракција различитих ткива у зглобу. Четврти задатак је припрема хрскавичних имплантата за накнадну трансплантацију. И коначно, пети задатак је проучавање фактора раста, цитокина или терапијских средстава која су способна да стимулишу репарацију и/или инхибирају ресорпцију хрскавице.
Током протеклих деценија, створени су различити модели ћелијских култура зглобне хрскавице, укључујући монослојне културе, суспендоване културе, хондронове културе, експлантате, кокултуре и бесмртне ћелијске културе. Свака култура има своје предности и мане, и свака је погодна за проучавање једног специфичног аспекта метаболизма хондроцита. Стога су експлантати хрскавице одличан модел за проучавање промета матричних елемената, што захтева праве рецепторе на ћелијској површини и нормалне интеракције ћелија-матрикс и матрикс-ћелија. Истовремено, препоручује се проучавање матричних депозита или механизама који регулишу метаболизам хондроцита на култури изолованих ћелија. Монослојна култура ниске густине је неопходна за проучавање процеса ћелијске диференцијације. Културе суспендоване у природном или синтетичком матриксу су модел за анализу адаптивног одговора хондроцита на механички стрес.
Хондроцитне културе
Приликом одабира хрскавичног ткива за in vitro студије треба узети у обзир неколико важних тачака. Састав матрикса и метаболичка активност хондроцита варирају међу зглобовима, а ово последње такође зависи од дубине локације хондроцита у ткиву. Ови подаци су добијени у неколико експеримената у којима су проучаване изоловане субпопулације хондроцита из хрскавичних зона различитих дубина. Пронађен је низ морфолошких и биохемијских разлика између култивисаних хондроцита који се налазе у површинским и дубоким слојевима зглобне хрскавице. Површинске ћелије синтетишу редак, протеогликанима сиромашан фибриларни матрикс, док дубље ћелије производе матрикс богат фибрилима и протеогликанима. Штавише, површинске ћелије производе релативно више малих неагрегираних протеогликана и хијалуронске киселине и релативно мање агрекана и кератан сулфата него дубљи хондроцити. Још једна важна карактеристика метаболизма хондроцита изолованих из хрскавичних зона различитих дубина је одговор на егзогени стимулус. Према М. Ајделоту и др., говеђи хондроцити из површинске зоне хрскавице били су осетљивији на ИЛ-1 него ћелије из дубоке зоне.
Понашање ћелија такође зависи од локације ткива. Хондроцити из хрскавице ребара и уха исте животиње различито реагују на факторе раста као што су фактор раста фибробласта (FGF) и TGF-бета. FGF је повећао уградњу тимидина, пролина и леуцина у култивисано ребро, али не и у хондроците уха. TGF-бета је повећао уградњу тимидина у хондроците хрскавице ребара и уха, али није имао утицаја на уградњу тимидина и пролина у хондроците уха. Ћелије хрскавице из подручја високог стреса разликују се од оних из подручја ниског стреса на хрскавицу. Дакле, хондроцити зреле хрскавице коленског зглоба оваца из централног региона зглобне површине тибије који није покривен менискусом, који носи највеће оптерећење in vivo, синтетишу мање агрекана, али више декорина него ћелије из зона покривених менискусом. Аутори такође истичу важност коришћења хрскавице из идентичних зглобних зона приликом проучавања синтетичке функције зглобова.
Метаболизам хондроцита и њихов одговор на регулаторне факторе такође значајно зависе од старости донора, његовог скелетног развоја и стања зглобова из којих се ћелије узимају. Код људских хондроцита примећује се значајно смањење пролиферативног одговора са годинама. Највеће смањење се примећује код донора старости 40-50 година и преко 60 година. Штавише, тежина пролиферативног одговора на факторе раста (нпр. FGF и TGF-бета) се смањује са старењем. Поред квантитативних промена у пролиферацији хондроцита, постоје и квалитативне промене. Ћелије младих донора (10-20 година) боље реагују на фактор раста изведен из тромбоцита (PDGF) него на TGF-бета, док се супротно примећује код ћелија одраслих донора. Неколико механизама се користи да би се објасниле промене у синтетичкој функцији хондроцита зависне од старости и њихов одговор на факторе раста. То укључује смањење броја и афинитета површинских ћелијских рецептора, промене у синтези и биоактивности фактора раста и цитокина и модификацију пострецепторских сигнала.
Патолошко стање зглобова такође мења морфологију и метаболичку активност хондроцита. Тако су Ј. Коури и др. (1996) идентификовали три субпопулације хондроцита у хрскавици код остеоартрозе. Хондроцити из површинског и горњег дела средишњег дела хрскавице формирају кластере и синтетишу већу количину протеогликана и колагена. TGF-бета и инсулину сличан фактор раста (IGF) су у стању да стимулишу синтезу протеогликана од стране хондроцита и делимично неутралишу ефекте IL-1 и TNF-α. Експлантати хрскавице погођене остеоартрозом и хондроцити изоловани из хрскавице пацијента са остеоартрозом су осетљивији на стимулацију TGF-бета него хондроцити здраве хрскавице. Ове разлике су највероватније повезане са фенотипским променама хондроцита у горњим слојевима зглобне хрскавице.
Изолација појединачних хондроцита постиже се секвенцијалним третманом ECM-а протеолитичким ензимима. Након њиховог ослобађања из ECM-а, изоловане ћелије су идеалне за проучавање de novo синтезе компоненти матрикса. Неки аутори користе само клостридијалну колагеназу, док други претходно инкубирају хрскавицу са трипсином, проназом, DNazom и/или хијалуронидазом. Број изолованих ћелија зависи од коришћених ензима. Дакле, када се третира само колагеназом, из 1 г ткива може се добити 1,4-10⁶ хондроцита, док се коришћењем проназе, хијалуронидазе и колагеназе -4,3-10⁶. Када се третирају колагеназом, агрекан, протеини, IL-6 и IL-8 остају у ћелијској култури у знатно већим количинама него код секвенцијалног третмана различитим ензимима. Постоји неколико објашњења за ове разлике између две ћелијске културе:
- Ћелијски рецептори су оштећени или инхибирани ензимима, TGF-бета инхибира синтезу ДНК и протеогликана у свеже изолованим хондроцитима (1. дан), док је синтеза ДНК и протеогликана у хондроцитима култивисаним у монослоју (7 дана) стимулисана помоћу TGF-бета. Међутим, потребан је адекватан период за поновну експресију ових мембранских компоненти пре почетка експеримента.
- Егзогене протеазе могу да поремете интеракцију ћелија-матрикс посредовану интегринима. Породица интегрина промовише везивање хондроцита за молекуле ECM (Shakibaei M. et al., 1997). Овај поремећај може утицати на експресију матричних гена.
- Остаци компоненти матрикса могу регулисати синтетичку функцију хондроцита. Интегрини су у стању да препознају производе разградње екстрацелуларног матрикса (ECM), те тако играју важну улогу у репарацији ткива након дејства протеолитичких ензима. Т. Ларсон и др. (1989) су известили да додавање интактних или фрагментираних протеогликана у ћелијску културу стимулише синтезу протеина и протеогликана. Међутим, висок ниво хијалуронске киселине узрокује значајно смањење укључивања сулфата у синтезу протеогликана од стране хондроцитa пилећег ембриона, зрелих хондроцитa свиње и ћелија хондросаркома пацова. Штавише, хијалуронска киселина је инхибитор ослобађања протеогликана из ћелија чак и у присуству IL-1b, TNF-a, FGF, што указује на супротстављање прве биолошке активности фактора раста и цитокина. Тачан механизам који лежи у основи дејства хијалуронске киселине остаје нејасан; Познато је да хондроцити садрже рецептор за хијалуронску киселину повезан са актинским филаментима цитосола. Везивање хијалуронске киселине за њен рецептор стимулише фосфорилацију протеина. Дакле, ови подаци показују модулацију метаболичке функције хондроцита фрагментираним или нативним молекулима матриксних протеина путем активације рецептора ћелијске мембране.
- Брза стимулација синтезе матриксних протеина од стране хондроцита ензимима може бити последица промена у облику хондроцита и/или реорганизације цитоскелета.
- Неки цитокини (нпр. IL-8) и фактори раста (нпр. IGF-1, TGF-β) су секвестрирани у ECM-у. Најпознатији пример је везивање TGF-β декорином, што резултира смањеном способношћу првог да индукује раст ћелија у ћелијама јајника кинеског хрчка. Откриће да се садржај декорина у хрскавици повећава са годинама сугерише смањење биодоступности TGF-β са старењем. Фактори раста и цитокини могу се ослободити из остатака матрикса током културе и потом модулирати функцију хондроцита.
Монослојна култура хондроцита
Диференцирани фенотип хондроцита првенствено карактерише синтеза колагена типа II и ткивно специфичних протеогликана, као и низак ниво митотске активности. Постоје докази да уз продужено култивисање ћелија у монослоју, као и након неколико поновљених ћелијских пасажа, хондроцити губе своје сферне обрисе и добијају издужени, фибробластима сличан облик. Код такве фибробластичне метаплазије, синтетичка функција ћелија је такође модификована, карактерише се прогресивним смањењем синтезе колагена типова II, IX и XI и повећањем синтезе колагена типова I, III и Y. Мали неагрегирани протеогликани се синтетишу због функционалног агрекана. Синтеза катепсина Б и Л је изузетно ниска у диференцираним ћелијама, али се повећава у процесу губитка диференцијације. Колагеназа-1 се експресује у диференцираним хондроцитима; уз продужено култивисање, њена експресија се смањује, док се производња ткивних инхибитора металопротеиназа (TIMP) повећава.
Диференцирани хондроцити поново експресују колаген диференцираног фенотипа када се пренесу из монослоја у суспендовану културу. Процес диференцијације је вероватно повезан са обликом ћелија. Ово својство редовно користе истраживачи који проучавају дефектне калемове са аутологним хондроцитима. Мали број ћелија добијених из биопсијског материјала може се проширити у монослојној култури, а затим поново увести у тродимензионалну матрицу пре трансплантације. Реекспресија специфичног фенотипа дедиференцираним хондроцитима пренетим у агарозну културу може се стимулисати помоћу TGF-β, осеин-хидроксиапатитног комплекса и аскорбинске киселине.
Као одговор на факторе раста и цитокине, хондроцити се модификују током процеса диференцијације. Ћелијски одговор на цитокине и факторе раста разликује се код недиференцираних и диференцираних хондроцита. IL-1 стимулише пролиферацију фибробласта, док IL-1 инхибира раст недиференцираних хондроцита. Синтезу ДНК стимулише IGF-1 у издуженим, али не и спљоштеним хондроцитима. У диференцираним хондроцитима, стимулативни ефекти IL-1бета и TNF-α на производњу проколагеназе су израженији него код недиференцираних хондроцита.
Култивација хондроцита
Култивација хондроцита у суспензији у течном медијуму или у природном или синтетичком тродимензионалном матриксу стабилизује фенотип хондроцита. Ћелије задржавају свој сферни облик и синтетишу ткивно специфичне протеине. Суспендована култура хондроцита се обично препоручује за проучавање формирања новог перицелуларног матрикса. Културе хондроцита у синтетичким или природним апсорбујућим полимерима користе се за имплантацију ћелија у дефекте хрскавице како би се стимулисала регенерација ткива зглобне хрскавице. Синтетички или природни медијум за имплантиране ћелије мора да испуњава низ захтева:
- имплантати морају имати порозну структуру за ћелијску адхезију и раст,
- ни сам полимер нити његови производи разградње не би требало да изазову упалу или токсичне реакције када се имплантирају in vivo,
- Носач калема мора имати способност везивања за суседну хрскавицу или субхондралну кост,
- Природна или синтетичка матрица мора имати способност апсорпције, њена разградња мора бити уравнотежена регенерацијом ткива,
- Да би се олакшала поправка хрскавице, хемијска структура и архитектура пора матрикса морају олакшати одржавање ћелијског фенотипа и синтезу ткивно специфичних протеина од стране хондроцита смештених у њему,
- Током имплантације in vivo, неопходно је проучити механичка својства синтетичке или природне матрице.
 [ 12 ], [ 13 ], [ 14 ], [ 15 ], [ 16 ]
[ 12 ], [ 13 ], [ 14 ], [ 15 ], [ 16 ]
Суспензија хондроцита у течној фази
Причвршћивање ћелија за пластичне посуде у којима се култивишу хондроцити може се спречити премазивањем њихових зидова раствором метилцелулозе, агарозе, хидрогела (поли-2-хидроксиетил метакрилата) или смешом колагена и агарозе. Под овим условима, хондроцити формирају кластере и синтетишу углавном агрекан и ткивно специфичне колагене (II, IX, XI типови). Обично се налазе две врсте ћелија. Ћелије које се налазе у центру задржавају сферни облик и окружене су добро развијеним ванцелуларним матриксом (ECM), што је потврђено хистохемијским и ултраструктурним студијама. На периферији, хондроцити имају дискоидне обрисе и окружени су ретким ECM-ом; мало се зна о функционалним карактеристикама таквих ћелија.
Могуће је култивисати хондроцете на микроносачима који се одржавају у суспензији; декстранске перлице (цитодекс), декстранске перлице обложене колагеном (цитодекс III) и непорозне микросфере колагена типа I (целаген) се користе као микроносачи. Под овим условима култивације, хондроцити се везују за површину микроносача, задржавају свој сферни облик и производе материјал сличан матрици. Штавише, употреба целогена подстиче пролиферацију хондроцита и поновну експресију нормалног фенотипа. Стога се култивисање хондроцита на целогенским микросферама може користити за обнављање ћелијског фенотипа пре трансплантације.
Друга метода култивације суспензије хондроцита у течном медијуму је њихово култивисање у облику густих куглица које се састоје од ћелија (0,5-1 * 10⁻⁶ ), добијених центрифугирањем. Такви хондроцити су способни да производе матрицу која садржи велику количину протеогликана, колагена типа II, али не и колагена типа I, што је потврђено хистолошким, имунохистохемијским и квантитативним методама.
Суспензија хондроцита у природном ECM-у
Хондроцити се могу култивисати у суспензији у тродимензионалном матриксу (меки агар, агароза, колагенски гел или сунђер, хијалуронска киселина, фибрински лепак, алгинатне перлице).
Хондроцити култивисани у агарози задржавају свој нормалан фенотип и синтетишу колаген типа II и ткивно специфичне агрегате агрекана. Када се култивишу у агарози, протеогликани које синтетише ћелија ослобађају се у медијум током 50 дана. Поређења ради, у монослојној култури, ћелијска фаза је препуњена гликозаминогликанима већ у првих 5-6 дана култивације; када се култивишу у медијуму, након повећане синтезе и ослобађања гликозаминогликана у првих 8-10 дана, долази до њиховог временски зависног смањења. Ипак, понашање хондроцита када се култивишу у агарози разликује се од оног in vivo. У агарози, велики број синтетисаних агрегата агрекана садржи мање молекуле и мање молекула него in vivo. TGF-β стимулише синтезу протеогликана у експлантату, али смањује синтезу агрекана у агарози.
Алгинат је линеарни полисахарид добијен из смеђих морских алги. У присуству двовалентних катјона, као што су Ca2 + јони, овај полимер постаје гел. Сваки хондроцит заробљен у алгинату окружен је матрицом негативно наелектрисаних полисахарида, чије су поре упоредиве са онима у хијалиној хрскавици. Матрица коју формирају хондроцити у алгинатним перлама састоји се од два одељка - танког слоја ћелијско повезане матрице која одговара перицелуларној и територијалној матрици зглобне хрскавице и удаљеније матрице еквивалентне интертериторијалној у нативном ткиву. На 30. дан културе, релативна и апсолутна запремина коју заузимају ћелије и сваки од два одељка у алгинатној перли су готово потпуно идентичне онима у нативној хрскавици. Скоро 30 дана, хондроцити задржавају свој сферни облик и производе агрекан, чија су хидродинамичка својства слична својствима молекула агрекана у матрици зглобне хрскавице, као и молекуле колагена типова II, IX и XI. Истовремено, као и код других суспензионих култура, на површини алгинатних перли присутне су спљоштене ћелије које производе малу количину молекула колагена типа I, који се директно ослобађају у медијум и нису уграђени у ECM. У алгинатним перлама се примећује умерена пролиферација хондроцита. Након 8 месеци култивације у алгинатном гелу, зрели хондроцити не губе метаболичку активност и настављају да синтетишу ткивно специфични колаген типа II и агрекан.
Х. Танака и др. (1984) истраживали су дифузиона својства различитих природних молекула у алгинату и открили да молекули већи од 70 kDa не дифундују кроз алгинат. Стога је ћелијска култура у алгинату погодна за проучавање регулације биосинтезе матрикса и организације екстрацелуларног матрикса (ECM). Доступност ћелија култивисаних у алгинату омогућава проучавање дејства пептидних регулаторних фактора и фармаколошких агенаса на транскрипционом, посттранскрипционом и транслационом нивоу.
Хондроцити се такође култивишу у матрици колагенских влакана типова I и II. С. Нерер и др. (1997) упоредили су функционисање псећих хондроцита у порозним колаген-протеогликанским полимерним матрицама које садрже колагене различитих типова. Пронашли су важне разлике у морфологији биосинтетске функције хондроцита култивисаних у колагенским матрицама које садрже колаген типове I и II. Ћелије у матрици колагена типа II задржале су свој сферни облик, док су у колагену типа I имале морфологију сличну фибробластима. Штавише, у матрици колагена типа II, хондроцити су произвели већу количину гликозаминогликана. Ј. ван Сусанте и др. (1995) упоредили су својства хондроцита култивисаних у алгинатном и колагенском (тип I) гелу. Аутори су открили значајно повећање броја ћелија у колагенском гелу, али од 6. дана култивације ћелије су изгубиле свој карактеристичан фенотип, претварајући се у ћелије сличне фибробластима. У алгинатном гелу примећено је смањење броја ћелија, али су хондроцити задржали свој нормалан фенотип. У колагенском гелу, број протеогликана по ћелији је био значајно већи него у алгинату, али је у гелу примећено смањење синтезе матричних елемената, почев од 6. дана култивације, док је у алгинату синтеза наставила да расте.
Чврста тродимензионална фибринска матрица је природна супстанца која подржава хондроците суспендоване у њој у диференцираном фенотипу. Тродимензионална фибринска матрица се такође може користити као носач у трансплантацији хондроцита. Предности фибрина су одсуство цитотоксичности, способност попуњавања простора и адхезивни капацитет. Хистолошке и биохемијске студије, ауторадиографија и електронска микроскопија показале су да хондроцити у фибринском гелу задржавају своју морфологију, пролиферишу и производе матрицу чак и након 2 недеље култивације. Међутим, Г. Хоминга и др. (1993) су известили да дезинтеграција фибрина почиње након 3 дана култивације и да дедиференцијација хондроцита напредује.
Суспензија хондроцита у вештачком (синтетичком) ECM-у
Хрскавични имплантати за реконструктивну или ортопедску хирургију могу се добити узгојем изолованих хондроцита in vitro у синтетичкој биокомпатибилној матрици.
Хондроцити култивисани у полигликолној киселини пролиферишу и одржавају нормалну морфологију и фенотип током 8 недеља. Комплекс хондроцита и полигликолне киселине састоји се од ћелија, гликозаминогликана, колагена и има спољашњу колагенску капсулу. Међутим, такви имплантати садрже две врсте молекула колагена - I и II. Имплантати из хондроцита дедиференцираних низом пасажа имају већу количину гликозаминогликана и колагена него имплантати из примарно недиференцираних хондроцита.
Л. Фрид и др. (1993б) упоредили су понашање култура људских и говеђих хондроцита у фиброзној полигликолној киселини (FPGA) и порозној полилактичној киселини (PPLA). Након 6-8 недеља култивације говеђих хондроцита у FPGA или PPLA, аутори су приметили ћелијску пролиферацију и регенерацију хрскавичаве матрице. У FPGA, хондроцити су имали сферни облик и налазили су се у лакунама окруженим хрскавичном матрицом. Након 8 недеља култивације in vitro, регенерисано ткиво је садржало до 50% суве материје (4% ћелијске масе, 15% гликозаминогликана и 31% колагена). У PPLA, ћелије су имале вретенасти облик и малу количину гликозаминогликана и колагена. У FPGA, раст ћелија је био 2 пута интензивнији него у PPLA. In vivo, хондроцити узгајани у VPGK и PPLC произвели су ткиво хистолошки слично хрскавици у року од 1-6 месеци. Имплантати су садржали гликозаминогликане, колагене типа I и II.
Хондроцити говеђих фетуса култивисани су у порозном хидрофобном и хидрофилном полиетилену високе густине. Након 7 дана инкубације у оба супстрата, ћелије су задржале сферни облик и садржале су углавном колаген типа II. Након 21 дана култивације, утврђено је да хидрофилни матрикс садржи више колагена типа II него хидрофобни матрикс.
Хрскавично ткиво се такође може добити култивацијом у монослоју на Millicell-CM филтерима. Претходно премазивање филтера колагеном је неопходно за везивање хондроитина. Хистолошки преглед културе показује акумулацију хондроцита у ECM-у који садрже протеогликане и колаген типа II. Колаген типа I није детектован у таквој култури. Хондроцити у добијеном хрскавичном ткиву су сферног облика, али на површини ткива су донекле спљоштени. Дебљина новоформираног ткива се повећавала временом и зависила је од почетне густине ћелијског монослоја. Под оптималним условима култивације, дебљина хрскавичног ткива достигла је 110 μm, организација његових ћелија и колагена у површинске и дубоке слојеве је слична оној у зглобној хрскавици. ECM садржи приближно 3 пута више колагена и протеогликана. Након 2 недеље култивације, примећена је акумулација матрикса, што је омогућило да се ткиво издвоји из филтера и користи за трансплантацију.
Симс и др. (1996) су проучавали култивацију хондроцита у полиетилен оксидном гелу, енкапсулираној полимерној матрици која омогућава пренос великог броја ћелија ињекцијом. Шест недеља након ињекције у поткожно ткиво атимичних мишева, формирана је нова хрскавица, која је морфолошки окарактерисана белом опалесценцијом сличном хијалиној хрскавици. Хистолошки и биохемијски подаци указали су на присуство активно пролиферирајућих хондроцита који производе ECM.
Експлантација
Експлантација хрскавичног ткива се користи за проучавање процеса ана- и катаболизма у њему, одржавања хомеостазе, ресорпције и поправке. Хондроцити у експлантима хрскавице одржавају нормалан фенотип и састав ванћелијског матрикса сличан онима у зглобној хрскавици in vivo. Након 5 дана култивације у присуству серума, постиже се константан ниво синтезе и природних процеса разградње. Ресорпција ткива може се убрзати у главној култури и у култури уз додатак серума коришћењем бројних агенаса, као што су IL-IB, TNF-a, бактеријски липополисахариди, деривати ретиноинске киселине или активни кисеонични радикали. За проучавање репарације хрскавице, њено оштећење се индукује растворљивим инфламаторним медијаторима (H 2 O 2, IL-1, TNF-a) или физичком руптуром матрикса.
Метода органотипске културе је модел за in vitro студије ефеката изолованих спољашњих фактора на хондроците и околни матрикс. In vivo, хондроцити су ретко распоређени у ванћелијском матриксу и не контактирају једни са другима. Култура експлантата зглобне хрскавице чува ову структурну организацију, као и специфичне интеракције између хондроцита и околне екстрацелуларне средине. Овај модел се такође користи за проучавање ефеката механичког стреса, фармаколошких агенаса, фактора раста, цитокина и хормона на метаболизам хрскавице.
Још једна предност експлантације хрскавичног ткива је одсуство оштећења хондроцита под дејством протеолитичких ензима или механичких фактора, што је неизбежно приликом изоловања ћелија. Рецептори и други мембрански протеини и гликопротеини су заштићени од штетних фактора.
 [ 17 ], [ 18 ], [ 19 ], [ 20 ], [ 21 ]
[ 17 ], [ 18 ], [ 19 ], [ 20 ], [ 21 ]
Хондронска култура
Хондрон је структурна, функционална и метаболичка јединица зглобне хрскавице која се састоји од хондроцита, његовог перицелуларног матрикса и компактне филаментозне капсуле и одговорна је за хомеостазу матрикса. Хондрони се механички екстрахују из хрскавице и сакупљају коришћењем неколико узастопних хомогенизација малом брзином. Хондрони изоловани из зона различите дубине хрскавице могу се поделити у четири категорије: један хондрон, упарени хондрони, вишеструки (три или више) линеарно распоређених хондрона (хондронске колоне) и кластери хондрона.
Појединачни хондрони се обично налазе у средњим слојевима интактне хрскавице, упарени хондрони се налазе на граници средњег и дубоког слоја, линеарно распоређени вишеструки хондрони су типични за дубоке слојеве интактне хрскавице. Коначно, кластери хондрона се састоје од насумично организованих група појединачних и упарених хондрона, који задржавају агрегирано стање након хомогенизације. Кластери хондрона су велики фрагменти хрскавице, који обично садрже неколико хондрона и радијално распоређене колагенске фибриле, тј. типичну организацију карактеристичну за дубоке слојеве матрикса. Хондрони су имобилизовани у транспарентној агарози, што омогућава проучавање њихове структуре, молекуларног састава и метаболичке активности. Систем хондрон-агароза се сматра микромоделом хрскавице, који се разликује од традиционалног система хондроцита-агарозе по томе што је природно микроокружење очувано и нема потребе за његовом синтезом и склапањем. Култура хондрона је модел за проучавање интеракција ћелија и матрикса у зглобној хрскавици под нормалним и патолошким условима.
 [ 22 ], [ 23 ], [ 24 ], [ 25 ], [ 26 ], [ 27 ]
[ 22 ], [ 23 ], [ 24 ], [ 25 ], [ 26 ], [ 27 ]
Култура бесмртних хондроцита
Рекомбинантна ДНК или вируси који садрже онкогене, способни да учине ћелију „бесмртном“, користе се за стварање трајних ћелијских линија. Бесмртни хондроцити имају способност да се бесконачно размножавају уз одржавање стабилног фенотипа. Ф. Малеин-Герин и др. (1995) су показали да онкоген SV40T индукује пролиферацију мишјих хондроцита, који настављају да стабилно експресују колаген типова II, IX и XI, као и артикуларни агрекан и везујући протеин. Међутим, таква ћелијска линија стиче способност да синтетише колаген типа I када се култивише у једнослојној култури или у агарозном гелу.
В. Хортон и др. (1988) су описали линију бесмртних ћелија са ниским нивоом експресије иРНК колагена типа II. Ове ћелије су добијене њиховом трансформацијом мишјим ретровирусом који садржи I-myc- и y-ra-онкогене. Овај тип ћелија представља јединствени модел за проучавање интеракција артикуларног матрикса у одсуству колагена типа II, као и регулацију синтезе колагена типа II.
Култура хондропрота са мутираним или избрисаним генима је погодан модел за проучавање њихове физиолошке функције. Овај модел је посебно погодан за проучавање улоге специфичних молекула у организацији хрскавичног матрикса или за испитивање ефеката различитих регулаторних фактора на метаболизам хрскавице. Хондроцити са избрисаним геном за колаген типа IX синтетишу колагенске фибриле које су шире од нормалних, што указује да колаген типа IX регулише пречник фибрила. Као што је наведено у Поглављу 1, мутација у COLAI гену који кодира колаген типа II недавно је откривена у породицама са примарним генерализованим остеоартритисом. Да би проучили ефекат мутантног колагена типа II на зглобни матрикс, Р. Дхармрварам и др. (1997) су ин витро трансфектовали (инфицирали страном нуклеинском киселином) дефектни COL 2 AI (аргинин на позицији 519 је замењен цистеином) у људске феталне хондроците.
Систем кокултуре. У зглобу, хрскавица интерагује са другим типовима ћелија које се налазе у синовијалној мембрани, синовијалној течности, лигаментима и субхондралној кости. На метаболизам хондроцита могу утицати различити растворљиви фактори које синтетишу наведене ћелије. Дакле, код артритиса, зглобна хрскавица се уништава протеолитичким ензимима и слободним радикалима које производе синовијалне ћелије. Стога су развијени модели за проучавање сложених интеракција између хрскавице и околних ткива, који се називају кокултуре.
С. Лакомб-Глејз и др. (1995) су култивисали зечје хондроците и остеобласте у систему кокултуре (COSTAR) у којем су ћелије биле раздвојене микропорозном мембраном (0,4 μm) што је омогућавало размену између два типа ћелија без икаквих директних контаката. Ова студија је показала способност остеобласта да стимулишу раст хондроцита путем растворљивих медијатора.
А. М. Малфе и коаутори (1994) проучавали су однос између моноцита периферне крви и хондроцита. Овај модел је погодан за проучавање процеса посредованих цитокинима код инфламаторних артропатија (реуматоидни артритис, серонегативни спондилоартритиси, итд.). Аутори модела су раздвојили ћелије мембраном која везује протеине са порама пречника 0,4 μm. Студија је показала да моноцити стимулисани липополисахаридом производе IL-1 и TNF-α, који инхибирају синтезу агрекана од стране хондроцита и доприносе разградњи већ синтетизованих агрегата агрекана.
К. Тада и др. (1994) су креирали модел кокултуре у коме су ендотелне ћелије у колагенском (тип I) гелу биле смештене у унутрашњу комору одвојену од спољашње коморе са хондроцитима смештеним у њој помоћу филтера са величином пора од 0,4 μм. У стању потпуне изолације од спољашње коморе, људске ендотелне ћелије су формирале цеви у колагенском гелу у присуству EGF или TGF-α. Када су обе врсте ћелија култивисане истовремено, формирање цеви зависно од TGF-α од стране ендотелних ћелија је било инхибирано. Инхибиција овог процеса од стране хондроцита је делимично елиминисана анти-TGF-β антителима. Може се претпоставити да TGF-β који производе хондроцити инхибира васкуларизацију саме хрскавице.
С. Грут и др. (1994) су истовремено култивисали хондроците из хипертрофичних и пролиферативних зона костију 16 дана старог фетуса миша са комадићима можданог ткива. Након 4 дана култивације, примећена је трансдиференцијација хондроцита у остеобласте и почетак формирања остеоида. Након 11 дана култивације, део хрскавице је замењен коштаним ткивом, а коштана матрица је делимично калцификована. Неки неуропептиди и неуротрансмитери које производи мождано ткиво утичу на метаболизам остеобласта или имају рецепторе за њих. Међу њима су норепинефрин, вазоактивни интестинални пептид, пептид повезан са геном калцитонина, супстанца П и соматостатин. Комадићи можданог ткива култивисани заједно са хондроцитима могу произвести неке од наведених фактора способних да индукују процес трансдиференцијације хондроцита у остеобласте.
 [ 28 ], [ 29 ], [ 30 ], [ 31 ], [ 32 ], [ 33 ]
[ 28 ], [ 29 ], [ 30 ], [ 31 ], [ 32 ], [ 33 ]
Утицај спољашњих фактора на културу хондроцита
Утицај тензије кисеоника на метаболизам хондроцита
У већини случајева, културе хондроцита се развијају у условима атмосферског напона кисеоника. Међутим, добро је познато да хондроцити in vivo постоје у хипоксичним условима и да напона кисеоника варира под различитим патолошким стањима. Током процеса сазревања, примећују се значајне промене у снабдевању крвљу епифиза. Пошто васкуларизација варира у различитим зонама плоче раста, варира и напона кисеоника у њима. Ц. Брајтон и Р. Хепенстал (1971) су показали да је у тибијалној плочи зечева напона кисеоника у хипертрофичној зони нижа него у околној хрскавици. Мерења неких метаболичких параметара показала су да су хондроцити способни да брзо реагују на локалне промене концентрације кисеоника. Пре свега, при ниском напону кисеоника, његова потрошња од стране хондроцита се смањује. Са смањењем напона кисеоника са 21 на 0,04%, повећава се искоришћавање глукозе, повећава се активност гликолитичких ензима и синтеза млечне киселине. Чак и при ниском напону кисеоника, апсолутна количина АТП, АДП и АМП остаје стабилна. Ови подаци указују да је метаболизам хондроцита усмерен ка максималној конзервацији енергије. Међутим, синтетичка активност, а самим тим и процеси репарације, мењају се у хипоксичним условима.
Висок притисак кисеоника такође утиче на метаболизам хондроцита, узрокујући смањење синтезе протеогликана и ДНК и разградњу хрскавичне матрице. Ови ефекти су обично праћени производњом слободних кисеоничних радикала.
Утицај концентрације јона и осмотског притиска околине на функцију хондроцита
У нативној хрскавици, концентрација јона се значајно разликује од оне у другим ткивима: садржај натријума у екстрацелуларној подлози је 250-350 mmol, а његова осмоларност је 350-450 mosmol. Када се хондроцити изолују из ECM-а и инкубирају у стандардној подлози (DMEM (Dulbecco's Minimal Essential Medium), осмоларност је 250-280,7 mosmol), окружење које окружује ћелије се драматично мења. Поред тога, концентрација калцијума и калијума у стандардној подлози је знатно нижа него у нативном ткиву, а концентрација ањона је знатно већа.
Додавање сахарозе у медијум повећава његов осмоларитет и индукује пролазно интрацелуларно повећање концентрације H + и калцијум ањона у цитосолу. Такве интрацелуларне промене могу утицати на процесе диференцијације хондроцита и њихову метаболичку активност. J. Urban et al. (1993) су открили да је инкорпорација 358 -сулфата и 3H -пролина од стране изолованих хондроцита инкубираних у стандардном DMEM-у током 2-4 сата била само 10% оне у нативном ткиву. Интензитет синтезе достигао је максимум при осмоларности екстрацелуларног медијума од 350-400 мосмол и у свеже изолованим хондроцитима и у експлантима хрскавичног ткива. Штавише, запремина хондроцита се повећала за 30-40% након стављања изолованих ћелија у стандардни DMEM специфициране осмоларности. Међутим, приликом култивације хондроцита у условима нефизолошке осмоларности током 12-16 сати, ћелије се прилагођавају новим условима, смањујући интензитет биосинтезе сразмерно померању осмоларности екстрацелуларне средине.
П. Боргети и др. (1995) проучавали су утицај осмоларности екстрацелуларне средине на раст, морфологију и биосинтезу свињских хондроцита. Аутори су показали сличне биохемијске и морфолошке карактеристике хондроцита култивисаних у медијумима са осмоларитетом од 0,28 и 0,38 мосмол. При осмоларности медијума од 0,48 мосмол, примећено је смањење ћелијске пролиферације и синтезе протеина током првих 4-6 сати култивације, али су се ови параметри накнадно опоравили и на крају достигли контролне вредности. Када су хондроцити култивисани у медијуму са осмоларитетом од 0,58 мосмол, ћелије су изгубиле способност да одрже физиолошки интензитет пролиферативних процеса, а након 6 дана број хондроцита је значајно смањен. При осмоларности медијума од 0,58 мосмол, примећена је дубока инхибиција синтезе протеина. Поред тога, када се култивишу у медијумима са осмоларношћу од 0,28-0,38 mOsm, хондроцити задржавају свој физиолошки фенотип; при вишој осмоларности (0,48-0,58 mOsm) долази до значајних промена у морфологији ћелија, што се манифестује губитком карактеристичног фенотипа, трансформацијом хондроцита у ћелије сличне фибробластима и губитком способности ћелија да склапају матриксне протеогликане. Резултати ове студије указују на способност хондроцита да реагују на ограничене флуктуације осмоларности екстрацелуларне средине.
Промене у концентрацији других јона такође могу утицати на процесе биосинтезе у хондроцитима. Тако се степен уградње 35S (сулфата) повећава за половину са повећањем концентрације калијумових јона од 5 mmol (концентрација у стандардном DM EM медијуму) до 10 mmol (концентрација у ECM in vivo). Концентрације калцијума испод 0,5 mmol подстакле су производњу колагена од стране зрелих говеђих хондроцита, док је концентрација од 1-2 mmol (што одговара концентрацији у стандардном DM EM медијуму) изазвала значајно смањење синтезе колагена. Умерено повећање биосинтезе примећено је при високим нивоима калцијума (2-10 mmol). Различити катјони учествују у везивању хондроцита за ECM протеине. Тако, јони магнезијума и мангана обезбеђују везивање за фибронектин и колаген типа II, док јони калцијума не учествују у везивању хондроцита за протеине. Дакле, резултати описаних студија указују на утицај промена екстрацелуларних јона калијума, натријума, калцијума и осмоларности медијума на биосинтетску функцију хондроцита инкубираних у стандардним медијумима.
Утицај механичког стреса на метаболизам хондроцита
Имобилизација зглоба изазива реверзибилну атрофију хрскавице, што указује на потребу за механичким стимулусима за нормалне метаболичке процесе у ванцелуларном матриксу (ECM). У већини случајева, модели ћелијске културе који се користе постоје под нормалним атмосферским притиском. М. Рајт и др. (1996) су показали да механичко окружење утиче на метаболизам хондроцита, ћелијски одговор зависи од интензитета и учесталости компресивног оптерећења. Експерименти са оптерећењем на експлантима интактне зглобне хрскавице in vitro показали су смањење синтезе протеина и протеогликана под дејством статичког оптерећења, док динамичко оптерећење стимулише ове процесе. Тачни механизми дејства механичког оптерећења на хрскавицу су сложени и вероватно су повезани са деформацијом ћелија, хидростатичким притиском, осмотским притиском, електричним потенцијалом и површинским ћелијским рецепторима за молекуле матрикса. Да би се проучио ефекат сваког од ових параметара, потребно је створити систем у коме се један параметар може независно мењати. На пример, култура експланта није погодна за проучавање деформације ћелија, али се може користити за проучавање општег ефекта притиска на метаболичку активност хондроцита. Компресија хрскавице доводи до деформације ћелија и праћена је појавом градијента хидростатичког притиска, електричног потенцијала, протока течности и променама физичко-хемијских параметара као што су садржај воде у матрици, густина електричног набоја и ниво осмотског притиска. Деформација ћелија може се проучавати коришћењем изолованих хондроцита уроњених у агарозни или колагенски гел.
Развијено је неколико система за проучавање ефекта механичке стимулације на културу хондроцита. Неки истраживачи користе системе у којима се притисак примењује на ћелијску културу кроз гасовиту фазу. Тако су ЈП Велдхуијзен и др. (1979), користећи притисак 13 kPa изнад атмосферског са ниском фреквенцијом (0,3 Hz) током 15 минута, приметили повећање синтезе цАМП-а и протеогликана и смањење синтезе ДНК. Р. Смит и др. (1996) су показали да је повремено излагање културе примарних говеђих хондроцита хидростатичком притиску (10 MPa) са фреквенцијом од 1 Hz током 4 сата изазвало повећање синтезе агрекана и колагена типа II, док константни притисак није утицао на ове процесе. Користећи сличан систем, Рајт и др. (1996) су известили да је циклични притисак на ћелијску културу повезан са хиперполаризацијом ћелијске мембране хондроцита и активацијом калијумових канала зависних од Ca2 +. Дакле, ефекти цикличног притиска су посредовани јонским каналима активираним истезањем у мембрани хондроцита. Реакција хондроцита на хидростатички притисак зависи од услова ћелијске културе и учесталости примењеног оптерећења. Дакле, циклични хидростатички притисак (5 MPa) смањује уградњу сулфата у монослој хондроцита на фреквенцији од 0,05, 0,25 и 0,5 Hz, док се на фреквенцији већој од 0,5 Hz уградња сулфата у експлантат хрскавице повећава.
М. Бушман и др. (1992) су известили да хондроцити у агарозним геловима мењају биосинтезу као одговор на статичко и динамичко механичко оптерећење на исти начин као и култивисани интактни орган. Аутори су открили да механичко оптерећење генерише хиперосмотски стимулус са накнадним смањењем pH вредности у хондроцитима.
Ефекат механичког истезања може се проучавати на ћелијској култури уроњеној у гел. Сила истезања може се створити помоћу компјутерски контролисаног вакуума. Када је систем под одређеним степеном вакуума, дно Петријеве шоље са ћелијском културом се протеже за познату количину, деформација је максимална на ивицама дна шоље, а минимална у центру. Истезање се такође преноси на хондроците култивисане у Петријевој шољи. Користећи ову методу, К. Холмвал и др. (1995) су показали да се у ћелијама хондросаркома култивисаним у колагенском (тип II) гелу повећава експресија мРНК 2β-интегрина . 2βинтегрин је способан да се веже за колаген типа II. Сматра се механорецептором, јер интерагује са протеинима који везују актин, повезујући тако ECM и цитоскелет.
Утицај pH вредности на метаболизам хондроцита
PH вредност интерстицијалне течности ванцелуларног матрикса хрскавчаног ткива је киселија него у другим ткивима. А. Марудас (1980) је одредио pH вредност матрикса зглобне хрскавице на 6,9. Б. Дијамант и др. (1966) су пронашли pH вредност од 5,5 у патолошким условима. Познато је да хондроцити живе на ниском PO2, што указује на важну улогу гликолизе (95% целокупног метаболизма глукозе) у метаболизму ових ћелија; гликолиза је праћена производњом велике количине млечне киселине.
Поред закисељавања средине производима гликолизе, саме компоненте матрикса су од великог значаја. Велика количина фиксног негативног наелектрисања на протеогликанима модификује екстрацелуларни јонски састав: примећује се висока концентрација слободних катјона (нпр. H +, Na +, K + ) и ниска концентрација ањона (нпр. O2, HCO3). Поред тога, под утицајем механичког оптерећења, вода се избацује из ванћелијског матрикса (ECM), што доводи до повећања концентрације фиксних негативних наелектрисања и привлачења више катјона у матрикс. Ово је праћено смањењем pH вредности екстрацелуларне средине, што утиче на интрацелуларну pH вредност, чиме се модификује метаболизам хондроцита. Р. Вилкин и А. Хол (1995) проучавали су утицај pH вредности екстрацелуларне и интрацелуларне средине на биосинтезу матрикса изолованим говеђим хондроцитима. Они су приметили двоструку модификацију синтезе матрикса са смањењем pH вредности. Благо смањење pH вредности (7,4
 [ 34 ], [ 35 ], [ 36 ], [ 37 ], [ 38 ], [ 39 ], [ 40 ]
[ 34 ], [ 35 ], [ 36 ], [ 37 ], [ 38 ], [ 39 ], [ 40 ]
Утицај састава подлоге за култивацију на метаболизам хондроцита
Подлога за култивацију хондроцита мора одговарати експерименталним условима. Последњих година, телећи серум се користи за оптимизацију услова култивације. Међутим, приликом коришћења серума, мора се узети у обзир низ важних тачака:
- спољашњи раст ћелија са периферије ткива у културама органа,
- варијабилност у саставу серума различитих серија,
- присуство непознатих компоненти у њима,
- повећан ризик од интерференције и артефаката приликом проучавања утицаја различитих биолошких фактора на метаболичку активност ћелија.
Пример овог последњег је студија ефекта EGF-а на хрскавчне хондроците код пацова. EGF је стимулисао уградњу 3H -тимидина и повећање садржаја ДНК у култури. Овај ефекат је био израженији при ниским концентрацијама у серуму (<1%), али је при високим концентрацијама (>7,5%) ефекат нестао.
Добро је познато да су нивои синтезе и разградње у ДМЕМ-у допуњеном телећим серумом значајно повећани у поређењу са условима in vivo. Разлике између метаболизма in vivo и in vitro могу бити последица разлика између синовијалне течности и медијума у којем се ћелије култивишу. Ли и др. (1997) су култивисали младе говеђе хондроците у агарози користећи хранљиви медијум који садржи ДМЕМ допуњен са 20% телећег серума и великом количином нормалне алогене синовијалне течности. Присуство синовијалне течности у медијуму изазвало је повећање количине протеогликана, до 80% укупне количине синовијалне течности. Ови резултати указују да синовијална течност у култури индукује ниво метаболизма сличан оном in vivo, са високим нивоом синтезе гликозаминогликана и ниским нивоом ћелијске деобе.
Г. Вербруген и др. (1995) су показали да је синтеза 35S -arrpeKaHa од стране људских хондроцита култивисаних у агарози у DMEM без серума била 20-30% нивоа синтезе примећеног у DMEM-у допуњеном са 10% телећег серума. Аутори су утврдили у којој мери су IGF-1, IGF-2, TGF-R или инсулин обнављали производњу агрекана у медијуму без серума. Аутори су закључили да је 100 нг/мл инсулина, IGF-1 или IGF-2 делимично обнављало синтезу агрекана на 39-53% контролног нивоа. Није примећен синергизам или кумулација са комбинацијом наведених фактора. Истовремено, 10 нг/мл TGF-R у присуству 100 нг/мл инсулина стимулисало је синтезу агрекана на 90% или више референтног нивоа. Коначно, људски серумски трансферин, сам или у комбинацији са инсулином, није утицао на синтезу агрекана. Када је телећи серум замењен говеђим серумским албумином, садржај агреканских агрегата се значајно смањио. Обогаћивање подлоге за култивацију инсулином, IGF-ом или TGF-R делимично је обновило способност ћелија да производе агреканске агрегате. Штавише, IGF-1 и инсулин су у стању да одржавају хомеостазу у ћелијским културама. Након 40 дана култивације у подлози обогаћеној са 10-20 нг/мл IGF-1, синтеза протеогликана је одржана на истом нивоу или чак и вишем у поређењу са подлогом која садржи 20% телећег серума. Катаболички процеси су се одвијали спорије у подлози обогаћеној IGF-1 него у подлози обогаћеној са 0,1% раствором албумина, али нешто брже у подлози обогаћеној са 20% серума. У дугоживућим културама, 20 нг/мл IGF-1 одржава стабилно стање ћелија.
Д. Ли и др. (1993) упоредили су ефекат састава подлоге за култивацију (DMEM, DMEM+20% телећег серума, DMEM+20 нг/мл IGF-1) на синтезу ДНК у култури експлантата хрскавчаног ткива, монослојној култури и у агарозној суспензији. Приликом култивације у агарози у присуству серума, аутори су приметили тенденцију груписања хондроцита у велике кластере. Ћелије култивисане без серума или са IGF-1 задржале су округли облик у агарози, сакупљене у мале групе, али нису формирале велике агрегате. У монослоју, синтеза ДНК је била значајно већа у подлози која садржи серум него у подлози обогаћеној IGF-1; синтеза ДНК у овој другој је била значајно већа него у необогаћеној подлози. Нису пронађене разлике у синтези ДНК када су хондроцити култивисани у агарозној суспензији у необогаћеној подлози и у подлози са IGF-1. Истовремено, култивисање суспензија хондроцита у агарози у медијуму обогаћеном серумом праћено је повећаном инкорпорацијом радионуклеотида 3H -тимидина у поређењу са другим медијумима.
Витамин Ц је неопходан за активацију ензима који учествују у формирању стабилне хеликоидне структуре колагенских фибрила. Хондроцити којима недостаје аскорбинска киселина синтетишу недохидроксиловане нехеликсне прекурсоре колагена, који се споро луче. Примена аскорбинске киселине (50 μг/мл) изазива хидроксилацију колагена типа II и IX и њихову секрецију у нормалним количинама. Додавање витамина Ц није утицало на ниво синтезе протеогликана. Стога се секреција колагена регулише независно од секреције протеогликана.

